Блок 1. Вещество
Атомы и молекулы. Химический элемент. Простые и сложные вещества
Химический элемент – это атомы одного и того же вида. Так, например, все атомы водорода – это элемент водород; все атомы кислорода и ртути – соответственно элементы кислород и ртуть.
В настоящее время известно более 107 видов атомов, то есть более 107 химических элементов. Нужно различать понятия "химический элемент”, "атом” и "простое вещество”
Простые и сложные вещества
По элементному составу различают простые вещества, состоящие из атомов одного элемента (H2, O2,Cl2, P4, Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H2O,NH3, OF2, H2SO4, MgCl2,K2SO4).
В настоящее время известно 115 химических элементов, которые образуют около 500 простых веществ.
Сложные вещества часто называют химическими соединениями, например оксид ртути(II) HgO (получается путем соединения атомов простых веществ - ртути Hg и кислорода O2), бромид натрия(получается путем соединения атомов простых веществ - натрия Na и брома Br2).
Итак, подытожим вышесказанное. Молекулы вещества бывают двух видов:
1. Простые – молекулы таких веществ состоят из атомов одного вида. В химических реакциях не могут разлагаться с образованием нескольких более простых веществ.
2. Сложные – молекулы таких веществ состоят из атомов разного вида. В химических реакциях могут разлагаться с образованием более простых веществ.
Различие понятий "химический элемент” и "простое вещество”
Отличить понятия "химический элемент” и "простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также в состав оксида углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических соединений, следует понимать, что в эти соединения входят не простые вещества, а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться в свободном состоянии и соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества. Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов.
Пользуясь понятием «химический элемент», можно дать такое определение простым и сложным веществам:
Простыми называют такие вещества, которые состоят из атомов одного химического элемента.
Сложными называют такие вещества, которые состоят из атомов разных химических элементов.
Сравнительная характеристика смесей и химических соединений
|
Вопросы для сопоставления смесей с химическими соединениями
|
Сопоставление
|
|
Смеси
|
Химические соединения
|
|
Чем отличаются по составу смеси от химических соединений?
|
Вещества можно смешивать в любых соотношениях, т. е. состав смесей переменный
|
Состав химических соединений постоянный.
|
|
Сопоставьте свойства смесей и химических соединений?
|
Вещества в составе смесей сохраняют свои свойства
|
Вещества, образующие соединения, свои свойства не сохраняют, так как образуется химическое соединений с другими свойствами
|
|
Какими способами можно разделить на составляющие компоненты смеси и химического соединения?
|
Вещества можно разделить физическими способами
|
Химические соединения можно разложить только с помощью химических реакций
|
|
Можно ли судить по внешним признакам об образовании смеси и химического соединения?
|
Механическое смешивание не сопровождается выделением теплоты или другими признаками химических реакций
|
Об образовании химического соединения можно судить по признакам химических реакций
|
НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА – соединения, образуемые всеми химическими элементами (кроме большинства органических соединений углерода). Делятся по химическому составу:
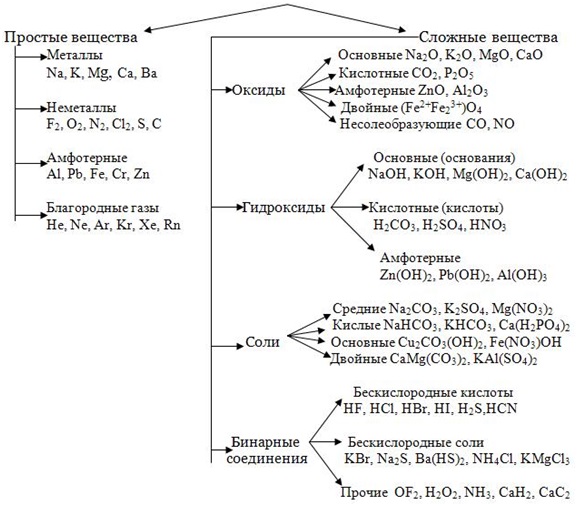
Металлы (от лат. metallum – шахта, рудник): группа элементов, обладающая характерными металлическими свойствами.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
1. Металлическая кристаллическая решетка – наличие подвижных электронов
2. Металлический блеск (неметаллы йод и углерод в виде графита)
Наиболее хорошо: алюминий, серебро, палладий и родий.
3. Твёрдое состояние (кроме ртути ).Обладают различной твёрдостью:
щелочные металлы режутся ножом, а ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло.
Ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло.
4. Пластичность - возможность лёгкой механической обработки.
Самыми пластичными являются золото, серебро и медь , германий и висмут непластичны.
5. Высокая теплопроводность и электропроводимость обусловлена наличием подвижных электронов.
Серебро, медь и алюминий имеют наибольшую электропроводность.
6. Высокая плотность
Металлы делят на:
1) лёгкие (плотность 0,53 ÷ 5 г/см³) . Самый лёгкий литий (плотность 0.53 г/см³).
2) тяжёлые (5 ÷ 22,5 г/см³). Самые тяжёлые металлы осмий и иридий (около 22.6 г/см³).
7. Температура плавления лежит в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам).
В РЕАКЦИЯХ ВСЕГДА ЯВЛЯЮТСЯ ВОССТАНОВИТЕЛЯМИ
Атомы металлов легко отдают электроны внешнего (а некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы
ВОЗМОЖНЫЕ СТЕПЕНИ ОКИСЛЕНИЯ Ме
Низшая 0,+1,+2,+3
Высшая +4,+5,+6,+7,+8
МЕТАЛЛЫ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (А) (ЩЕЛОЧНЫЕ МЕТАЛЛЫ)
литий, натрий, калий, рубидий, цезий, франций
Мягкие металлы, легко режутся ножом.
На срезе белого цвета с блеском, исчезающим на воздух
МЕТАЛЛЫ II ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (А)
бериллий, магний, щелочноземельные металлы (кальций, стронций, барий) и радий
АЛЮМИНИЙ И ЭЛЕМЕНТЫ III-A ГРУППЫ
Алюминий - серебристо-белый легкий металл.
Отличительные особенности алюминия - высокая электропроводимость, теплопроводность, коррозионная стойкость, малая плотность и отличная обрабатываемость давлением в холодном состоянии.
Цинк — элемент побочной подгруппы второй группы (В), четвёртого периода
Хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Медь - тяжелый розово-красный металл, мягкий и ковкий.
Железу присущи все металлические свойства:
- пластичность
- электро- и теплопроводность
- характерный металлический блеск.
Металл обладает магнитными свойствами.
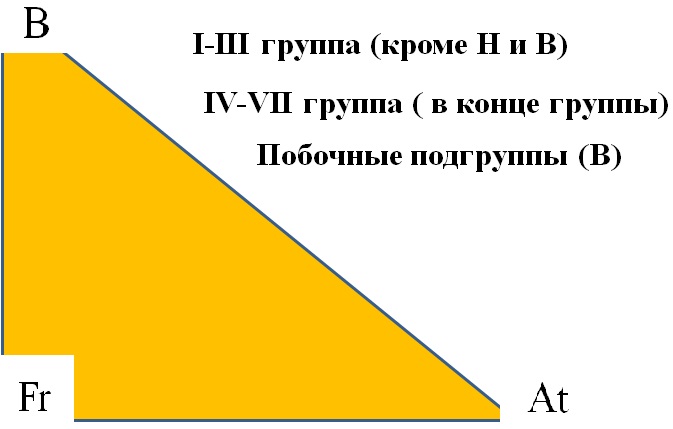
НЕМЕТАЛЛЫ
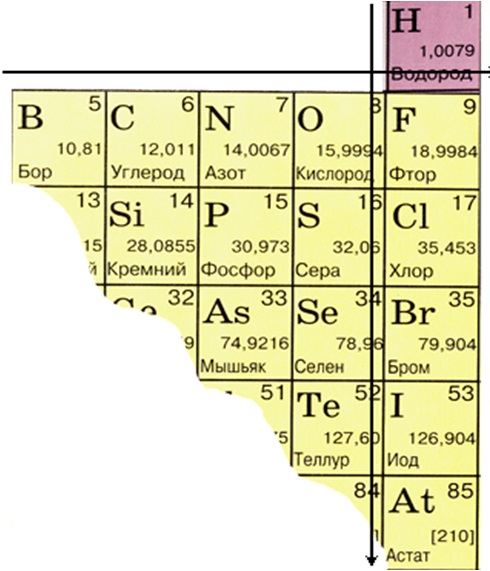
Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ, из них 6 – инертные газы (8A). Элементы с неметаллическими свойствами находятся в IIIA-VIIA - группах Периодической системы:
Особенности атомного строения неметаллов:
1. Небольшой атомный радиус
2. На внешнем уровне 4-8 электронов (исключение водород – 1 электрон, гелий – 2 электрона)
3. Располагаются только в главных подгруппах
4. Характерно высокое значение ЭО
5. Степени окисления от -4 до +8
Химические связь ковалентная неполярная или вещества атомарного строения
АТОМАРНОЕ СОСТОЯНИЕ
Инертные или благородные газы не образуют молекул и существуют в атомарном состоянии (не образуют решеток)
He –гелий, Ne-неон , Ar-аргон , Kr-криптон , Xe-ксенон , Rn-радон
АТОМНЫЕ КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ: алмаз (С) и кремний (Si)
3. МОЛЕКУЛЯРНАЯ НЕПОЛЯРНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА
Многие неметаллы образуют молекулу, состоящую из двух атомов ( H2 , O2 , N2 , F2, Cl2 , Br2, I2), при этом образуется очень непрочная связь.
При обычной температуре неметаллы могут быть в разном агрегатном состоянии
1. Газообразные - O2 - кислород , H2 - водород, N2 - азот , Cl2 - хлор, F2 - фтор.
2. Жидкие - Br2 - бром
3. Твердые – S –сера, P-фосфор, I2 –йод, C–-алмаз и графит
Многие не проводят электрический ток (кроме графита и кремния).
Не проводят тепло.
В твердом состоянии - хрупкие
Не имеют металлического блеска (кроме иода-I2 , графита-C и кремния Si)
Цвет охватывает все цвета спектра: красный-красный фосфор, желтый –сера, зеленый-хлор, фиолетовый –пары иода.
Температура плавления изменяется в огромном интервале: tпл (N2)= -210⁰C , а tпл (Алмаз) =3730⁰С
АЛЛОТРОПИЯ
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями, или модификациями.
КИСЛОРОД
Кислород образует две аллотропные модификации (причина- строение молекулы)
КИСЛОРОД O₂: Газ без цвета и запаха Входит в состав воздуха (21% по объему). Не ядовит!
ОЗОН O3: Газ бледно-фиолетового цвета с резким запахом свежести.
Обладает бактерицидными свойствами, способен удерживать ультрафиолетовые лучи.
СЕРА
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t кип = 445 °С
Возможные валентности: II, IV, VI. Степени окисления: -2, 0, +4, +6
У серы можно выделить три аллотропных модификации: кристаллическая(ромбическая),моноклинная и пластическая.
Переход из кристаллической в пластическую происходит при нагревании до температуры кипения при последующем быстром охлаждении.
АЗОТ
Азот – газ без цвета и запаха, плохо растворим в воде. Азот является основной частью воздуха (79% по объѐму).
ФОСФОР
Образует семь аллотропных модификаций, причиной является строение кристаллической решётки.
Фосфор белый P₄( молекулярная кристаллическая решётка )
Мягкое, бесцветное вещество. В темноте светится. Ядовит!
Фосфор красный Pn ( атомная кристаллическая решётка) аморфное
полимерное вещество(порошок). в темноте не светится, ядовит
УГЛЕРОД
образует две аллотропные формы (причина – строение кристаллической решётки)
Алмаз: Тетраэдрическая кристаллическая решетка
Бесцветные кристаллы. Самое твердое вещество в природе . tпл=3730ºC
Графит: Кристаллическая решетка напоминает соты
Слоистое кристаллическое вещество, жирное на ощупь , непрозрачное ,серого цвета.
ПРОСТЫЕ И СЛОЖНЫЕ ВЕЩЕСТВА.
Простые вещества состоят из атомов одного ХЭ, сложные вещества - из атомов двух и более ХЭ.
БИНАРНЫЕ СОЕДИНЕНИЯ:
а) галогениды: OF2, KBr, NH4Cl, BrF3
б) хальгогениды : Na2S, ZnS, K2Se, NiSe
в) нитриды: Li3N, Mg3N2, Si3N4
г) карбиды: Al4C3, CaC2, Fe3C
д) силициды: Li4Si, Mg2Si, ThSi2
е) гидриды: LiH, CaH2, SiH4
ж) пероксиды. H2O2, Na2O2, СаO2
з) надпероксиды: HO2, КO2, Ва(O2)2
ОКСИДЫ
бинарное соединение химического элемента с кислородом в степени окисления − 2, в котором сам кислород связан только с менее электроотрицательным элементом.
В соответствии с номенклатурой ИЮПАК (систематической), оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже,
например: Na2O — оксид натрия, Al2O3 — оксид алюминия.
Если элемент имеет переменную степень окисления, то в названии оксида указывается его степень окисления римской цифрой (валентность) в скобках сразу после названия (без пробела).
Например: Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII).
Классификация оксидов (по агрегатному состоянию)
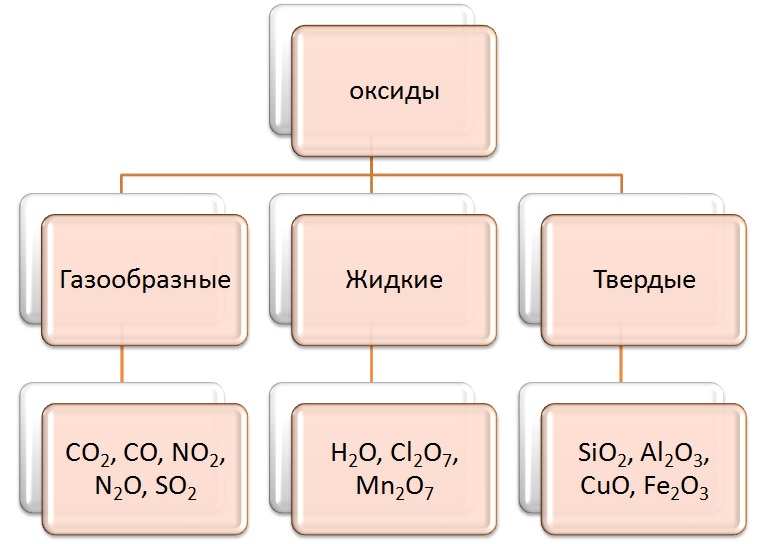
Классификация оксидов по составу
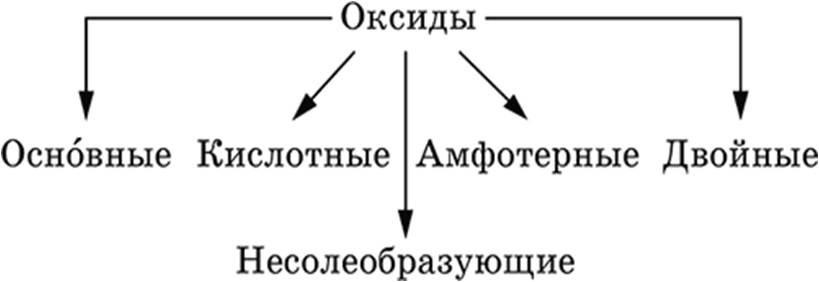
НЕСОЛЕОБРАЗУЮЩИЕ ОКСИДЫ – оксиды неметаллов, не вступающие в реакции солеобразования (отличие от основных, кислотных и амфотерных оксидов),
например: СО, NO, N2O «веселящий газ», SiO, S2O.
СОЛЕОБРАЗУЮЩИМИ называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
СОЛЕОБРАЗУЮЩИЕ ДЕЛЯТСЯ НА основные, кислотные, амфотерные.
ОСНÓВНЫЕ ОКСИДЫ - СООТВЕТСТВУЮТ ОСНОВАНИЯ.
Образованы металлами в низших степенях окисления (+1, +2).Исключение: оксиды бериллия, цинка
КИСЛОТНЫЕ ОКСИДЫ – СООТВЕТСТВУЮТ КИСЛОТЫ.
Образованы металлами и неметаллами любой степени окисления
( валентность V – VI), степень окисления от +5 до +7
АМФОТЕРНЫЕ ОКСИДЫ – соответствуют амфотерные гидроксиды (двойственная природа).
Образованы амфотерными металлами (валентность II – IV): BeO, Cr2O3, ZnO, Al2O3, Fe₂O₃
ОСНОВАНИЯ
Вещества, состоящие из атомов металла (NH₄⁻ - иона аммония) и одной или нескольких гидроксогрупп ОН
КЛАССИФИКАЦИЯ ПО РАСТВОРИМОСТИ В ВОДЕ (таблица растворимости)
1. Растворимые основания - щелочи:
гидроксид натрия NaOH, гидроксид кали KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH,гидроксид кальция Ca(OH)2
2. Нерастворимые основания - все остальные:
Например: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Be(OH)2 .
Другие основания: NH3·H2O
Названия гидроксидов составляются из слова «гидроксид» и названия металла в родительном падеже. Если металл образует несколько оснований, то в названиях указывается степень его окисления римской цифрой (валентность) в скобках сразу после названия элемента.
Например:
NaOH – гидроксид натрия;
Fe(OH)3 – гидроксид железа (III);
Ca(OH)2 – гидроксид кальция;
CuOH – гидроксид меди (I).
В русском языке применяются традиционные названия для некоторых важных и часто применяемых соединений.
Например:
NaOH – едкий натр, каустическая сода;
Ca(OH)2 – известковая вода (раствор Ca(OH)2 в воде), гашеная известь, известковое молочко;
KOH – едкое кали;
Ba(OH)2 – баритовая вода (раствор Ba(OH)2 в воде) и др.
АМФОТЕРНЫЕ ГИДРОКСИДЫ
Амфотерные гидроксиды образованы элементами с амфотерными свойствами, т. е. проявляют свойства кислот и оснований.
Типичные амфотерные гидроксиды: Be(OH)2, Al(OH)3, Zn(OH)2, Cr(OH)3, Fe(OH)3
КИСЛОТЫ
Кислоты состоят из атомов водорода и кислотного остатка.
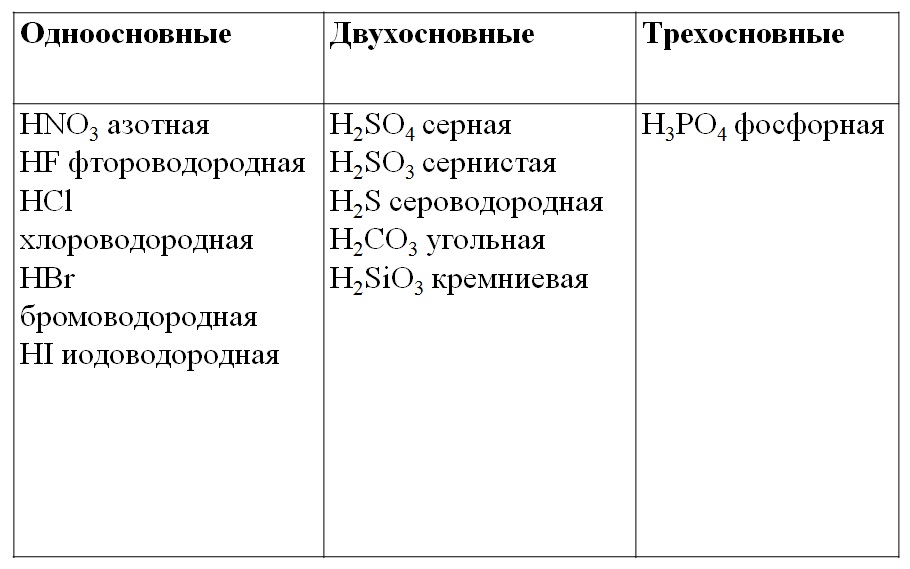
КЛАССИФИКАЦИЯ КИСЛОТ ПО СОСТАВУ

КЛАССИФИКАЦИЯ КИСЛОТ ПО ЧИСЛУ АТОМОВ ВОДОРОДА
КЛАССИФИКАЦИЯ КИСЛОТ ПО СИЛЕ

CОЛИ
Выделяют несколько групп солей: средние, кислые, основные, комплексные.
Средние соли
Соединения, состоящие из катионов металла (NH₄⁺) и анионов кислотных остатков.
Названия средних солей состоят из двух частей: названия аниона (кислотного остатка) в именительном падеже и катиона в родительном.
Число катионов и анионов, как правило, не указывается. Если один и тот же металл проявляет различную степень окисления, то её указывают в скобках римской цифрой.
Например, CuSO4 – сульфат меди (II); NaCl – хлорид натрия.
Кислые соли
Названия кислых солей образуются добавлением к аниону приставки гидро-, и, если необходимо, то с соответствующим числительным.
Например, NaHSO4 – гидросульфат натрия; KH2PO4 – дигидрофосфат калия.
Основные соли
Названия основных солей образуются добавлением к аниону приставки гидроксо-, и, если необходимо, то с соответствующим числительным.
Например, AlOHSO4 – гидроксосульфат алюминия; Fe(OH)2Cl – дигидроксохлорид железа (III).
Комплексные соли
Содержат сложный комплексный анион (или реже катион), состоящий из металла-комплексообразователя и нескольких лигандов (отрицательно заряженные ионы или молекулы аммиака или воды).
Например: Na[Al(OH)4] – тетрагидроксоалюминат натрия

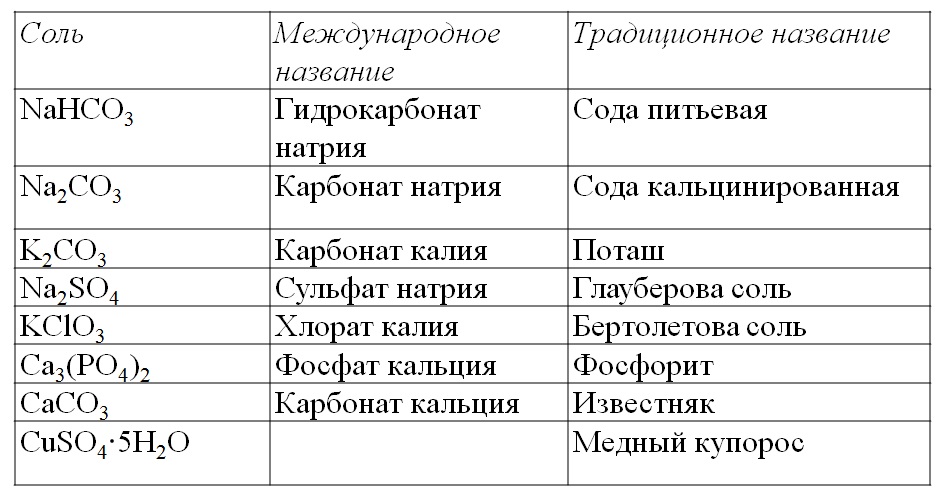
Тривиальные названия некоторых солей
| 


 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход Поиск
Поиск Друзья сайта
Друзья сайта Наш опрос
Наш опрос Статистика
Статистика










