Блок 2. Химическая реакция
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних). Реакции ионного обмена и условия их осуществления
ЭЛЕКТРОЛИТЫ
Это вещества, растворы и расплавы которых проводят электрический ток.
ИОНЫ - заряженные частицы: Cl-, Cu2+, NO3-
КАТИОНЫ – ионы с зарядом +
АНИОНЫ – ионы с зарядом –
СВОЙСТВА ИОНОВ ОТЛИЧАЮТСЯ ОТ СВОЙСТВ АТОМОВ, ИЗ КОТОРЫХ ОНИ ОБРАЗОВАЛИСЬ!!!
Процесс распада электролитов на ионы в процессе растворения или расплавления называется ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИЕЙ.
ЭЛЕКТРОЛИТЫ:
Все растворимые веществ в таблице растворимости (исключение H₂SO₃, H₂S, H₂CO₃,NH₄OH)
НЕЭЛЕКТРОЛИТЫ:
- нерастворимые неорганические вещества;
- органические вещества спирты, эфиры, альдегиды, углеводороды, углеводы. (исключение: кислоты, соли и фенолы):
КАК ПРОИСХОДИТ ПРОЦЕСС РАСТВОРЕНИЯ ЭЛЕКТРОЛИТА?
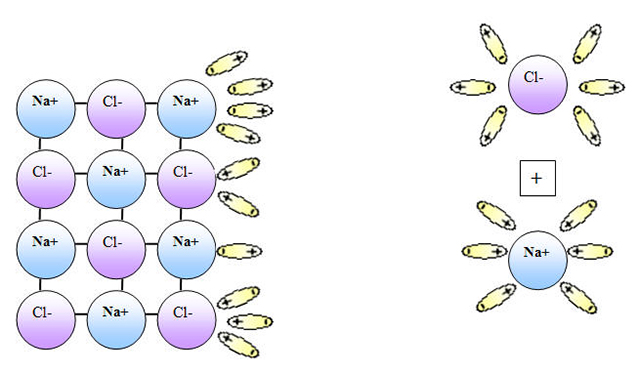
Растворение поваренной соли и соляной кислоты.
Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой – положительно.
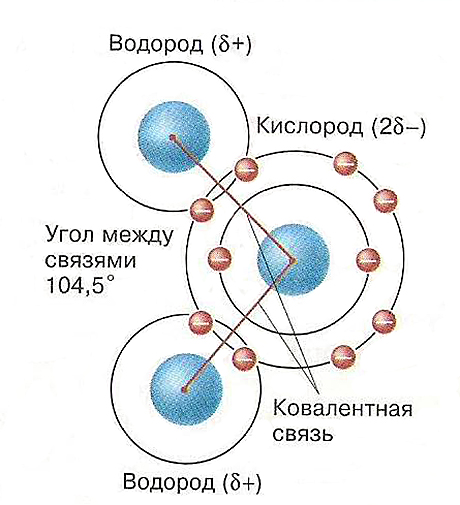
Молекула воды отрицательным полюсом подходит к иону натрия, положительным – к иону хлора; окружают ионы со всех сторон и вырывают из кристалла, причём только с его поверхности.
 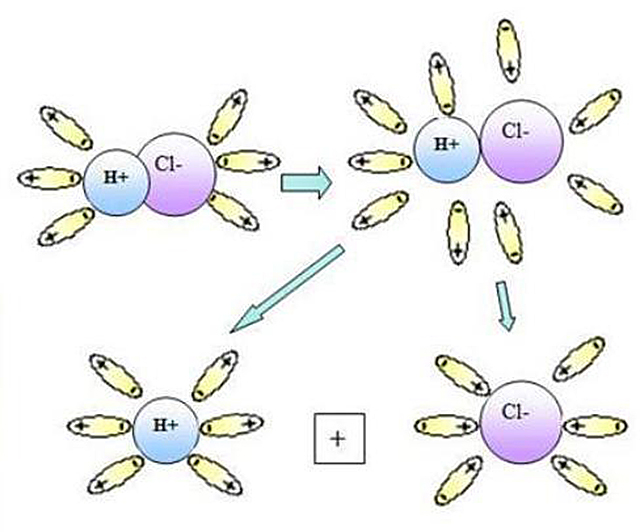
Свободные ионы, оказавшиеся в водном растворе, окружаются полярными молекулами воды: вокруг ионов образуется гидратная оболочка, т.е. протекает процесс гидратации.
ДИССОЦИАЦИЯ ВЕЩЕСТВ
КИСЛОТЫ
электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Н3РО4 ↔ Н+ + Н2РО4- (первая ступень)
Н2РО4- ↔ Н+ + НРO42- (вторая ступень)
НРО42- ↔ Н+ PО4З- (третья ступень)
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей
ОСНОВАНИЯ
электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
KOH ↔ K+ + OH-;
NH4OH↔ NH4+ + OH-
ОСНОВАНИЯ, РАСТВОРИМЫЕ В ВОДЕ НАЗЫВАЮТСЯ ЩЕЛОЧАМИ
Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН.
Большинство оснований в воде малорастворимо.
СОЛИ
электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH4+) и анионы кислотных остатков
(NH4)2SO4 ↔ 2NH4+ + SO42-;
Na3PO4 ↔ 3Na+ + PO43-
РЕАКЦИИ ИОННОГО ОБМЕНА
это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются ионами.
ПРАВИЛО БЕРТОЛЛЕ
Реакции обмена в растворах электролитов возможны только тогда, когда в результате реакции образуется твердое малорастворимое вещество, газообразное или малодиссоциирующее.
ZnO + Н2SО4 = ZnSО4 + Н2О,
AgNО3 + КВr = АgВr↓ + КNО3,
К2СО3 + 2НСl = 2КСl +Н2О + СО2↑
СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ИОННОГО ОБМЕНА:
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl
2. Определяем и указываем заряды ионов, определяем растворимость каждого вещества (таблица растворимости).
ИСКЛЮЧЕНИЕ:
В таблице растворимости некоторые вещества указаны растворимы, но растворяются они только в закрытых сосудах, в открытых образуются газообразные вещества:
NH4OH → NH3↑ + H2O
H2SO3 → SO2↑ + H2O
H2CO3 → CO2↑ + H2O
H2S↑
р р н р
3NaOH + FeCl3 = Fe(OH)3 ¯+ 3NaCl
3. Составляем полное ионное уравнение.
Сильные электролиты записывают в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записывают в виде молекул.
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3↓ + 3Na+ + 3Cl-
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3↓ + 3Na+ + 3Cl-
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe3+ + 3OH- = Fe(OH)3 ↓
В ВИДЕ ИОНОВ НЕ ЗАПИСЫВАЮТ:
1. Неэлектролиты (оксиды, простые вещества);
2. Осадки; газы; воду; слабые электролиты (кислоты и основания);
3. Анионы кислотных остатков кислых солей слабых кислот (НСО3-, Н2РО4- и т.п.) и катионы основных солей слабых оснований Al(OH)2+.
ПРИМЕРЫ СОСТАВЛЕНИЯ ИОННЫХ УРАВНЕНИЙ.
Пример 1
Сульфид цинка + соляная кислота à
н р р р
ZnS + 2HCl = ZnCl2 + H2S ↑
молекулярная форма
ZnS +2H++2Cl-=Zn2++2Cl-+ H2S↑
полное ионно-молекулярное уравнение
ZnS +2H+=Zn2++ H2S ↑
сокращенное ионное уравнение
При составлении молекулярного уравнения из сокращенного ионного, для ионов с левой стороны составляем, используя таблицу растворимости, растворимые вещества.
На основе их, заканчиваем правую часть.
Расставляем коэффициенты.
Пример 2
Ag⁺ + Вr⁻ = АgВr↓
AgNО3 + КВr = АgВr↓ + КNО3 | 


 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход Поиск
Поиск Друзья сайта
Друзья сайта Наш опрос
Наш опрос Статистика
Статистика



