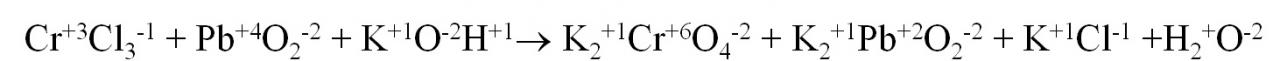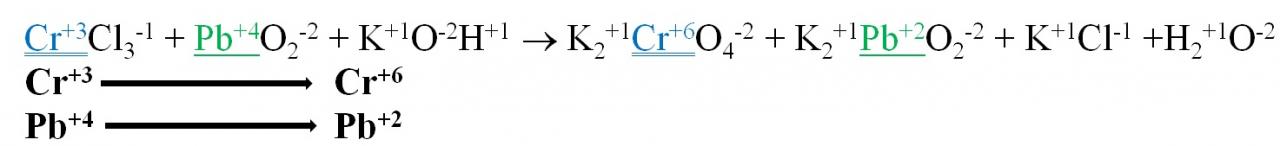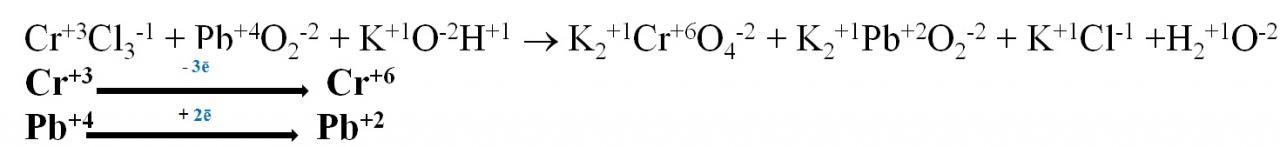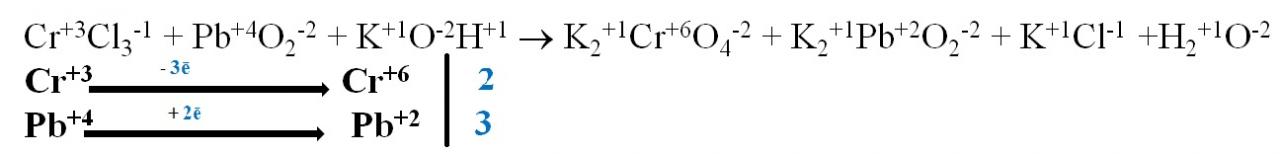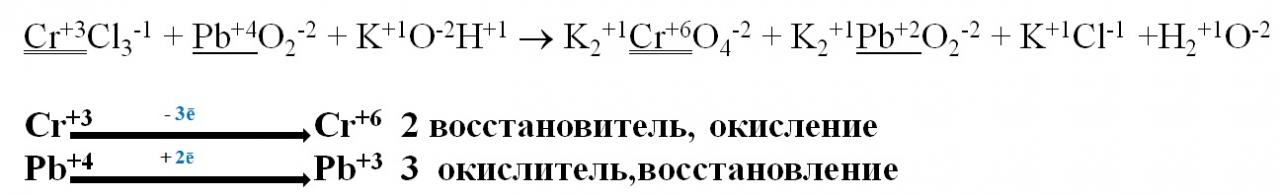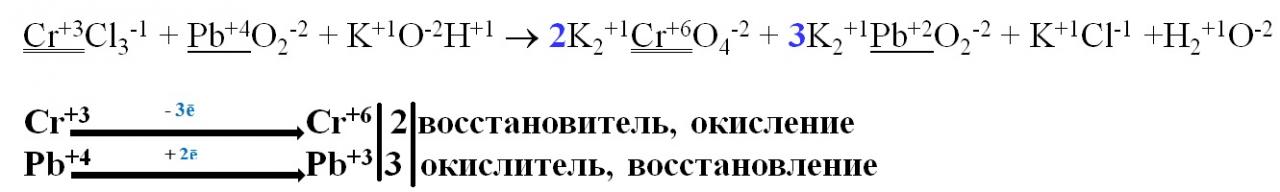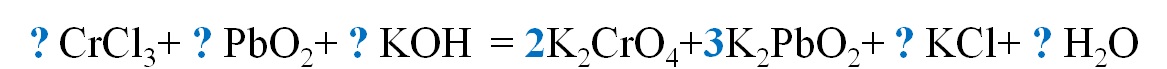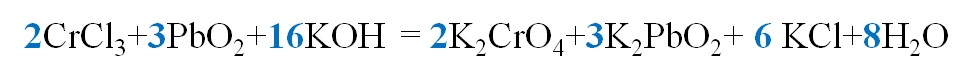Блок 2. Химическая реакция
Окислительно-восстановительные реакции. Окислитель и восстановитель
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов.
ОКИСЛИТЕЛИ - это атомы, ионы или молекулы, которые ПРИНИМАЮТ электроны (степень окисления понижается).
Окислитель принимает электроны – это процесс ВОССТАНОВЛЕНИЯ.
Типичные окислители:
1) Оксиды, кислоты, соли с максимально положительной степенью окисления входящего в них элемента.
Например: кислоты – HNO3, H2SO4, HClO4, H2Cr2O7;
соли – KСlO4, KClO3, KNO3, KMnO4, K2Cr2O7;
оксиды –PbO2, Mn2O7, CrO3, N2O5
2) Самые активные неметаллы – фтор, кислород, озон
ВОССТАНОВИТЕЛИ - это атомы, ионы или молекулы, которые ОТДАЮТ электроны (степень окисления повышается).
Восстановитель отдает электроны – это процесс ОКИСЛЕНИЯ.
Типичные восстановители:
1) Bсе металлы (они могут только отдавать электроны);
2) Bещества с минимально возможной (отрицательной) степенью окисления неметалла.
Например: водородные соединения – РН3, HI, HBr, H2S;
соли – KI, NaBr, K2S.
Все остальные вещества в зависимости от условий могут быть как окислителями, так и восстановителями: Н2О2, KNO2, Cl2, простые вещества-неметаллы могут как принимать, так и отдавать электроны.
Составление окислительно – восстановительных уравнений реакций методом электронного баланса.
Основное требование
Число электронов, отданных восстановителем = числу электронов, принятых окислителем.
CrCl3+PbO2+KOH=K2CrO4+K2PbO2+KCl+H2O
1. Указываем степени окисления каждого элемента
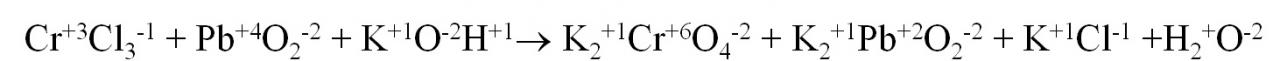
2.Находим элементы, изменившие степень окисления

3. Составляем электронный баланс
Выписывает элементы, изменившие степень окисления
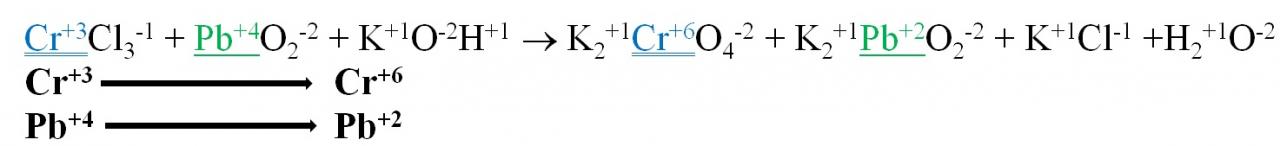
4. Определяем количество отданных и присоединенных электронов
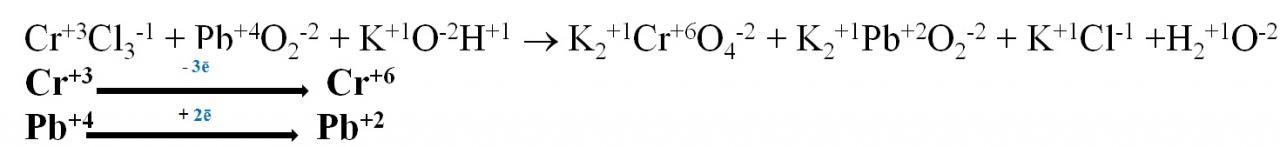
5. Находим коэффициенты, которые необходимо поставить у элементов, изменивших степень окисления
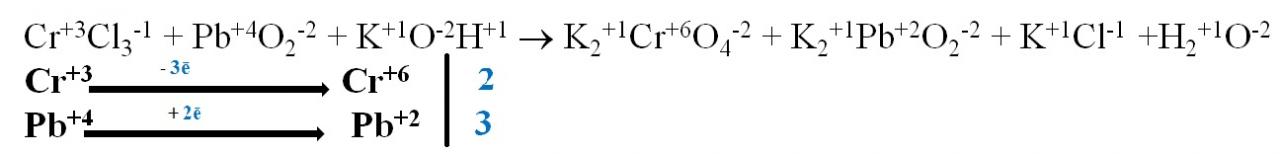
6. Указываем окислитель и восстановитель, или процесс окисления и восстановления (противоположны)
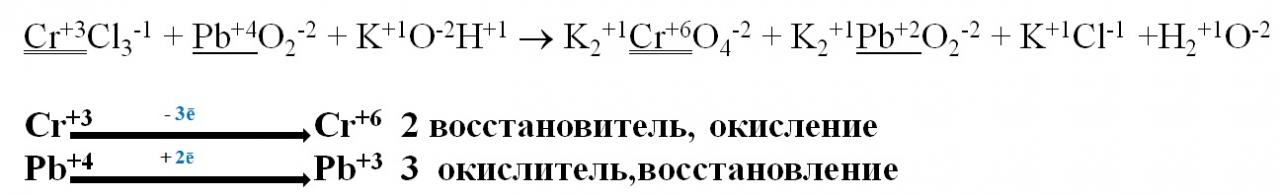
7. Устанавливаем найденные коэффициенты
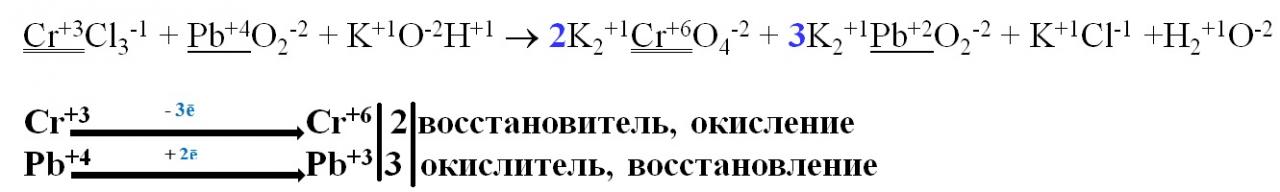
8. Остальные коэффициенты находим методом подбора.
Сначала уравнивают элементы, повторяющиеся один раз, затем те, у которых стоят коэффициенты, затем водород и кислород.
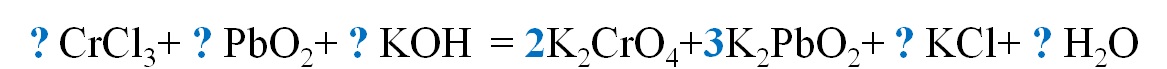
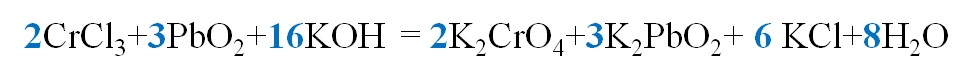
| 


 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход Поиск
Поиск Друзья сайта
Друзья сайта Наш опрос
Наш опрос Статистика
Статистика