Блок 2. Неорганическая химия
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Химия, как и любая наука, имеет свой язык, причем письменная форма химического языка играет более важную роль по сравнению с его устной формой. Основным отличием языка химии от обычных языков является наличие в нем номенклатурных правил, то есть таких правил, руководствуясь которыми можно давать названия элементам, соединениям. Для химика наиболее важны правила называния огромного числа известных химических соединений.
Надо обратить внимание, что неорганическая химия более древняя наука, чем остальные разделы химии. Существовали две объективные причины препятствующие созданию единой систематизированной химической номенклатуры - наличие языковых барьеров (одно и то же вещество может по-разному называться на национальных языках) и сложившиеся традиции в крупных сообществах химиков, работающих в разных странах.
Только в 1978 году номенклатурная комиссия ИЮПАК (Международный союз теоретической и прикладной химии) на своем съезде решила упорядочить названия химических элементов и создать современную номенклатуру. Целью современной систематической химической номенклатуры является однозначное описание состава и, по мере возможности, строения соединений. Необходимо, чтобы по названию можно было бы написать формулу и наоборот. Например, знакомая нам серная кислота по новой номенклатуре называлась бы тетраоксосульфат диводорода; зато по этому названию легко написать формулу. Соединение называется справа налево: тетра 4, оксо –кислород О4, сульфат – сера SO4, ди – 2 - 2SO4, водорода – Н - Н2SO4. По названию написали формулу. Но традиции есть традиции, и решили современную номенклатуру адаптировать для каждой страны. В нашей стране этим занимался профессор МГУ Бокий. Новые соединение (комплексные) уже называются по новой номенклатуре.
В соответствии с этими правилами названия соединений можно разделить на три категории.
1. Рекомендованные названия химических соединений, построенные в соответствии с принципами систематической химической номенклатуры.
2. Альтернативные (традиционные) названия соединений, построенные с нарушением принятых новых принципов номенклатуры, но имеющие широкое распространение.
3. Неноменклатурные (тривиальные или специальные) названия, которые подлежат изъятию из языка.
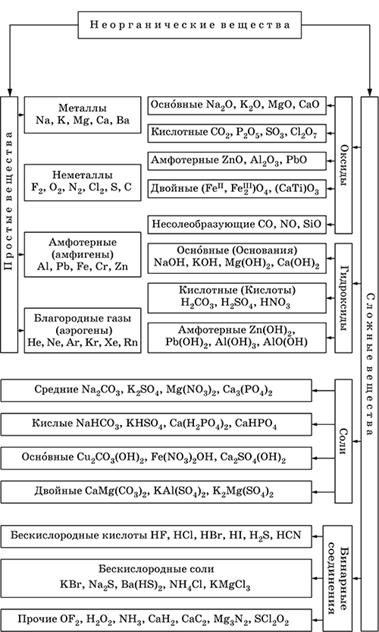
Простые вещества
По составу соединения подразделяются на: простые (состоящие из одного типа химических элементов), бинарные (состоящие из двух элементов) и сложные.
По функциональным признакам простые вещества делятся на металлы и неметаллы, их названия приведены в периодической системе элементов Менделеева. Неметаллов мало, всего 22. К неметаллам относят все элементы VIIIА-группы (благородные газы) и VIIА-группы (галогены), элементы VIА-группы (кроме полония), элементы азот, фосфор, мышьяк (VА-группа); углерод, кремний (IVА-группа); бор (IIIА-группа), а также водород. Остальные элементы относят к металлам.
Бинарные соединения
В бинарных соединениях – справа располагается более электроотрицательный элемент: например NaCl - хлорид натрия. В названии бинарных соединений к корню более электроотрицательного элемента добавляется суффикс -ид (силицид, нитрид, фторид, карбид, гидрид, оксид и т.д.). Некоторые псевдобинарные соединения называются также как бинарные. Например, NaCN – цианид натрия, NaSCN – роданид натрия. Интерметаллиды (соединения металлов между собой) называются отлично от остальных бинарных соединений, например, Cu3Au – три медь золото.
Сложные соединения
Основность кислоты – число Н+ групп в молекуле.
Кислотность основания – число ОН групп в молекуле.
Номенклатура оснований
Основания называются как бинарные соединения. Если металл переменной валентности, то обязательно указывается его степень окисления (римскими цифрами в круглых скобках). Например Fe(OH)3 – гидроксид железа(III); Fe(OH)2 – гидроксид железа (II).
Номенклатура кислот
В бескислородных кислотах используется суффикс «о» – НСl (хлор0водород); HF (фтор0водород) и т.д.
Кислородные кислоты.
Если элемент образует несколько кислот в разной степени окисления кислотообразующего элемента, то в случае высшей валентности добавляется суффикс –ная (H2SO4 – серная) или –овая (H2CrO4 – хромовая). S и Cr имеют степень окисления +6 и находятся в VI группе (значит это высшая степень окисления. Для не высшей степени окисления суффикс –истая (H2SO3 – сернистая) или –овистая(HAsO2 – мышьяковистая) Степень окисления серы +4, находится в VI группе (не высшая степень окисления). Степень окисления мышьяка +3, находится в V группе (не высшая степень окисления).
Для элементов, образующих кислоты в более чем две степени окисления, например, для кислородных кислот хлора (HClO, HClO2, HClO3, HClO4) используются следующие суффиксы в названии кислот.
HClO – хлорноватистая, степень окисления хлора +1;
HClO2 - хлористая, степень окисления хлора +3;
HClO3 - хлорноватая, степень окисления хлора +5;
HClO4 - хлорная, степень окисления хлора +7;
Если кислоты отличаются только количеством воды в кислоте, то в названии кислоты богатой водой используется приставка «орто», например ортофосфорная Н3РО4. Если в кислоте мало воды, то используется приставка «мета», например метафосфорная НРО3.
Если в кислоте имеется два и более кислотообразующих элемента, то используются греческие приставки (ди-, три-, тетра- и т.д.).
H2Cr2O7 – дихромовая; H2B4O7 – тетраборная.
Номенклатура солей
Средние соли
Если кислотообразующий элемент находится в высшей степени
окисления, то к корню элемента добавляется суффикс ат, если не в высшей, то – ит. Например Na2SO4 – сульфат натрия, Na2SO3 – сульфит натрия. К солям орто- или метакислот добавляются их приставки. Например, Na3РO4 – ортофосфат натрия, NaРO3 – метафосфат натрия.
Для солей кислот, имеющих два и более кислотообразующих элемента, используются греческие приставки (ди-, три-, тетра- и т.д.).
К2Cr2O7 – дихромат калия; Na2B4O7 – тетраборат натрия.
Для солей галогенокислородных кислот используются следующие суффиксы и приставки:
КClO - гипохлорит
КClO2 - хлорит
КClO3 - хлорат
КClO4 – перхлорат.
Кислые соли могут образовывать только многоосновные кислоты. При этом добавляется приставка гидро-.
NaHSO4 – гидросульфат натрия.
NaH2PO4 – дигидрофосфат натрия.
Основные соли могут образовывать только многокислотные основания. При этом добавляется приставка гидроксо-.
(СаОН)2SO4 – сульфат гидроксокальция.
MgOHCl – хлорид гидроксомагния.
Al(OH)2Cl – хлорид дигидроксоалюминия.
Обращаю Ваше внимание, что в Al(OH)2Cl – хлориде дигидроксоалюминия на 1 моль алюминия приходится 2 моль ОН-, поэтому приставка ди-.
Для (СаОН)2SO4 – сульфата гидроксокальция на 1 моль кальция приходится 1 моль ОН-, поэтому просто гидроксо-.
Пример.
Напишите названия следующих соединений: Ca(NO2)2, Cr2O3, CrO3, H3PO4, HPO3, HPO2.
Напишите формулы соединений по их названиям: сульфат гидроксокальция, гидросульфит железа(II), оксид азота(I), метасиликат натрия, ортосиликат калия.
Решение.
Ca(NO2)2 – нитрит кальция. Азот (+3) находится не в высшей степени окисления, значит суффикс ит . Кальций – металл постоянной валентности, степень окисления не ставится.
Cr2O3 – оксид хрома( III ). Бинарное соединение, значит суффикс ид . Хром – металл переменной валентности, ставим степень окисления.
CrO3 - оксид хрома(VI).
H3PO4 – ортофосфорная кислота. Фосфор в высшей степени окисления – окончание –ная, воды много – приставка орто- .
HPO3 - метафосфорная кислота. Фосфор в высшей степени окисления – окончание –ная, воды мало – приставка мета- .
HPO2 - метафосфористая кислота. Фосфор (+3) не в высшей степени окисления – окончание –истая , воды мало – приставка мета- .
Сульфат гидроксокальция – (СаОН)2SO4 сульфат, значит соль серной кислоты (сера в высшей степени окисления (+6)), приставка гидроксо-, значит к катиону (Са) добавляется ОН-. Заряд СаОН+ стал +2 -1 = +1, а заряд сульфат иона SO42-;
Гидросульфит железа (II) – Fe(HSO3)2 сульфит, значит соль сернистой кислоты H2SO3 (сера не в высшей степени окисления (+4)),приставка гидро-, значит к аниону добавляется Н+. Заряд HSO3 - стал -2 +1= -1, а Fe2+;
Оксид азота (I) – N2O - суффикс - ид значит бинарное соединение, азот – элемент переменной валентности, степень окисления +1;
Метасиликат натрия – Na2SiO3 – суффикс –ат значит кремний в высшей степени окисления (+4). приставка мета-, значит то соль метакремниевой кислоты (мало воды) Н2SiO3;
Ортосиликат калия – К4SiO4 – кремний (+4) в высшей степени окисления, значит суффикс –ат. Это соль ортокремниевой кислоты (много воды) Н4SiO4.
|



 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход Поиск
Поиск Друзья сайта
Друзья сайта Наш опрос
Наш опрос Статистика
Статистика