| Среда, 26.11.2025, 11:25 | Главная | Регистрация | Вход |
Сайт учителя биологии и географии Лотоцкой Е. Г. |
|
| Статьи по биологии [132] |
| Статьи по географии [29] |
| Статьи по химии [30] |
| Выступления [3] |
 Поиск
Поиск
 Друзья сайта
Друзья сайта
 Наш опрос
Наш опрос
 Статистика
Статистика
Онлайн всего: 6
Гостей: 6
Пользователей: 0

Статьи, выступления
| Главная » Статьи » Статьи по химии |
Энтальпия
Водяной пар, пропускаемый над углем при 600 °С, реагирует с ним с образованием оксида углерода углерода и водорода: 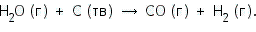 ΔH = H (продуктов реакции) — H (реагирующих веществ) = (HСО + HН2) — (HН2О + HС). Поскольку реакция идет с поглощением тепла, образующиеся продукты реакции имеют более высокое теплосодержание, и величина ΔH будет положительной. Это можно записать следующим образом: 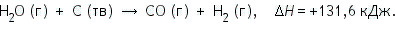 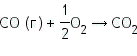 При этой реакции происходит выделение тепла. Следовательно, энтальпия продуктов реакции ниже, чем энтальпия реагирующих веществ. Поэтому величина ΔH для реакции будет отрицательной. Мы видим, что знак ΔH может быть положительным или отрицательным. Он положителен, если энтальпия повышается (за счет поглощения тепла), и отрицателен, если энтальпия понижается (за счет выделения тепла). Химические реакции, при протекании которых происходит уменьшение энтальпии системы (ΔH < 0) и во внешнюю среду выделяется теплота (Q > 0), называются экзотермическими. Реакции, в результате которых энтальпия возрастает (ΔH > 0) и система поглощает теплоту извне (Q < 0), называются эндотермическими. Окисление глюкозы кислородом происходит с выделением теплоты (Q = 2800 кДж/моль), то есть этот процесс — экзотермический. Соответствующее термохимическое уравнение запишется в виде: С6Н12О6 + 6О2 = 6СО2 + 6Н2О, ΔH = -2800 кДж.
Горение, а также процессы, протекающие при участии кислорода, (ржавление, гниение), протекают с выделением тепла. Кислород применяется для получения высоких температур. Если сжигать водород в токе кислорода, то при образовании 1 моль воды выделяется 286,3 кДж. Высокие температуры, достигаемые в пламени таких горелок, (до 3000 °С) используются для резки и сварки металлов. | |
| Просмотров: 384 | Рейтинг: 0.0/0 |
| Всего комментариев: 0 | |


| Лотоцкая Елена © 2025 | Сайт создан в системе uCoz
Некоторые файлы и информация, находящиеся на данном сайте, были найдены в сети ИНТЕРНЕТ, как свободно распространяемые, присланы пользователями сайта или найдены в альтернативных источниках, также использованы собственные материалы. Автор сайта не претендует на авторство ВСЕХ материалов. Если Вы являетесь правообладателем той или иной продукции или информации, и условия, на которых она представлена на данном ресурсе, не соответствуют действительности, просьба немедленно сообщить с целью устранения правонарушения. |
 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход
