| Пятница, 26.04.2024, 22:50 | Главная | Регистрация | Вход | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Сайт учителя биологии и географии Лотоцкой Е. Г. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Статьи по биологии [132] |
| Статьи по географии [29] |
| Статьи по химии [30] |
| Выступления [3] |
 Поиск
Поиск
 Друзья сайта
Друзья сайта
 Наш опрос
Наш опрос
 Статистика
Статистика
Онлайн всего: 1
Гостей: 1
Пользователей: 0

Статьи, выступления
| Главная » Статьи » Статьи по химии |
Электронные оболочки атомов
Главное квантовое число
Если рассматривать элементы последовательно по увеличению заряда ядра, то становится очевидным, что заполнение электронами соответствующего слоя идет до определенного числа электронов, после чего начинается заполнение следующего электронного слоя, или энергетического уровня. Энергетические уровни нумеруются, начиная от ядра: 1, 2, 3, 4, 5, 6 и 7.Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом. Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, расположенные наиболее близко к ядру. По сравнению с электронами первого уровня электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня. Наибольшее число электронов на энергетическом уровне определяется по формуле: N = 2n2
где N — максимальное число электронов; n — номер уровня, или главное квантовое число. Следовательно, на первом, ближайшем к ядру энергетическом уровне, может находиться не более двух электронов;на втором — не более 8; на третьем — не более 18; на четвертом — не более 32. А как, в свою очередь, устроены энергетические уровни (электронные слои)? Строение электронных уровней Начиная со второго энергетического уровня (n = 2), каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром. Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один подуровень; второй — два; третий — три; четвертый — четыре подуровня. Подуровни, в свою очередь, образованы орбиталями. По форме различают 4 известных ныне типа орбиталей, которые обозначают латинскими буквами s, p, d и f. Графическое изображение электронных орбиталей элементов первого и второго периодов представлено на модели 1: Каждому значению n соответствует число орбиталей, равное n2. По данным, представленным в таблице 1, можно проследить связь главного квантового числа n с числом подуровней, типом и числом орбиталей и максимальным числом электронов на подуровне и уровне.
Таблица 1. Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях
Подуровни принято обозначать латинскими буквами, равно как и орбитали, из которых они состоят: s, p, d, f.
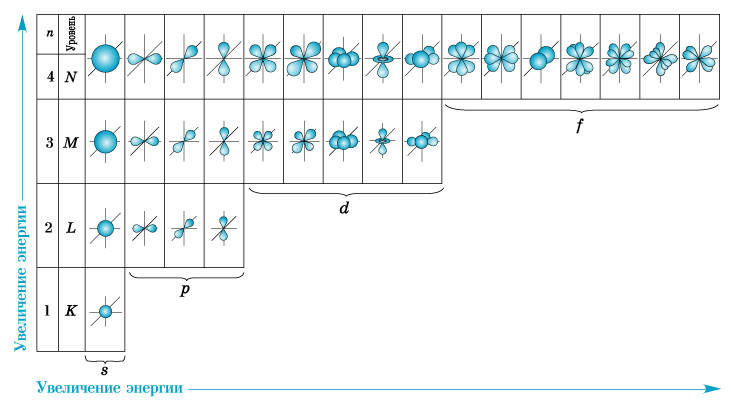 Рис. 1. Форма и размер электронных орбиталей атомов элементов Рис. 1. Форма и размер электронных орбиталей атомов элементовПорядок заполнения электронных уровней в атомах легких элементов Рассмотрим характер заполнения электронных уровней в атомах элементов с порядковым номером от Z = 3 до 20. Как было сказано ранее, первый от ядра уровень может содержать не более двух электронов, два последующих уровня — не более восьми.
Таблица 1. Заполнение электронных уровней атомов химических элементов
Элементы, имеющие на внешнем уровне одинаковое число электронов, называются электронными аналогами. Следовательно, сходство элементов, входящих в одну группу электронных аналогов, определяется одинаковым числом «валентных» электронов, то есть электронов, расположенных на внешнем электронном уровне. Однако, между этими элементами должны существовать и определенные различия, обусловленные разным числом электронных уровней. Таким образом, число электронов на внешнем уровне и число электронных уровней являются важнейшими характеристиками атомов, определяющими физические и химические свойства тех веществ, в состав которых они входят. Каждое число в Периодической системе характеризует какую-либо особенность в строении атомов: Порядковый (атомный) номер химического элемента указывает на заряд его атомного ядра, то есть на число протонов, содержащихся в нем, а так как атом электронейтрален, то и на число электронов, находящихся вокруг атомного ядра. Номер периода соответствует числу энергетических уровней (электронных слоев) в атомах элементов данного периода, заселенных электронами. Номер группы соответствует числу электронов на внешнем уровне для элементов главных подгрупп и максимальному числу валентных электронов побочных подгрупп. 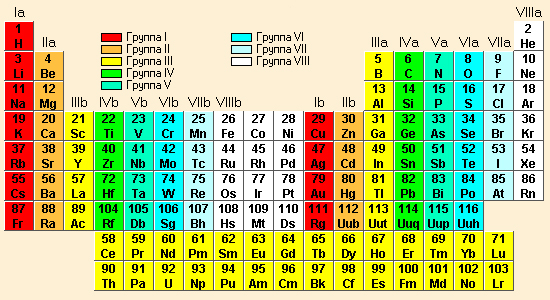 Рис. 1. Таблица Менделеева В свете строения атома можно объяснить причины изменения свойств химических элементов и образованных ими веществ. В периоде с увеличением зарядов атомных ядер элементов (слева направо) металлические свойства ослабевают, а неметаллические усиливаются в силу того, что:
В группах (главная подгруппа) с увеличением зарядов ядер элементов (сверху вниз) металлические свойства усиливаются, неметаллические ослабевают. Это объясняется тем, что:
В больших периодах такие изменения происходят медленнее, так как, начиная с третьего элемента, у атомов достраивается не последний, а предпоследний энергетический уровень с 8 до 18 электронов (у элементов побочных подгрупп), а лишь затем заполняется последний уровень с 2 до 8 электронов (у элементов главных подгрупп). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Просмотров: 531 | Рейтинг: 0.0/0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Всего комментариев: 0 | |

| Лотоцкая Елена © 2024 | Сайт создан в системе uCoz
Некоторые файлы и информация, находящиеся на данном сайте, были найдены в сети ИНТЕРНЕТ, как свободно распространяемые, присланы пользователями сайта или найдены в альтернативных источниках, также использованы собственные материалы. Автор сайта не претендует на авторство ВСЕХ материалов. Если Вы являетесь правообладателем той или иной продукции или информации, и условия, на которых она представлена на данном ресурсе, не соответствуют действительности, просьба немедленно сообщить с целью устранения правонарушения. |
 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход
