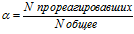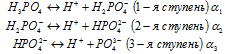| Пятница, 11.07.2025, 14:45 | Главная | Регистрация | Вход |
Сайт учителя биологии и географии Лотоцкой Е. Г. |
|
| Статьи по биологии [132] |
| Статьи по географии [29] |
| Статьи по химии [30] |
| Выступления [3] |
 Поиск
Поиск
 Друзья сайта
Друзья сайта
 Наш опрос
Наш опрос
 Статистика
Статистика

| Главная » Статьи » Статьи по химии |
Электролитическая диссоциация — это процесс распада вещества на ионы при его растворении или расплавлении. KCl → K+ + Cl– В этом случае процесс диссоциации практически необратим. При растворении веществ с ковалентной полярной связью также могут происходить разрыв этой связи и гидратация образующихся ионов, например: HCl ↔ H+ + Cl– В этих случаях процесс диссоциации, как правило, обратим.
В зависимости от степени диссоциации электролиты делят на сильные и слабые. К сильным электролитам относят те, для которых степень диссоциации в растворе с концентрацией 0.1 моль/л больше 0.3 (30%). Это практически все соли, сильные кислоты (НСl, Н2SО4, НNО3, НСlO4 и т.д.), гидроксиды щелочных и щелочно-земельных металлов.
Степень диссоциации по каждой последующей ступени на несколько порядков меньше по сравнению с предыдущей: Информация с сайта http://netlik.hop.ru/disociaciy.html | |
| Просмотров: 774 | Рейтинг: 0.0/0 |
| Всего комментариев: 0 | |


| Лотоцкая Елена © 2025 | Сайт создан в системе uCoz
Некоторые файлы и информация, находящиеся на данном сайте, были найдены в сети ИНТЕРНЕТ, как свободно распространяемые, присланы пользователями сайта или найдены в альтернативных источниках, также использованы собственные материалы. Автор сайта не претендует на авторство ВСЕХ материалов. Если Вы являетесь правообладателем той или иной продукции или информации, и условия, на которых она представлена на данном ресурсе, не соответствуют действительности, просьба немедленно сообщить с целью устранения правонарушения. |
 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход