| Вторник, 23.04.2024, 09:13 | Главная | Регистрация | Вход | |||||
Сайт учителя биологии и географии Лотоцкой Е. Г. |
|
|||||
| « Февраль 2017 » | ||||||
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
| 1 | 2 | 3 | 4 | 5 | ||
| 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 27 | 28 | |||||
 Друзья сайта
Друзья сайта
 Наш опрос
Наш опрос
 Статистика
Статистика

13:33 Блок 1. Вещество (часть 3) |
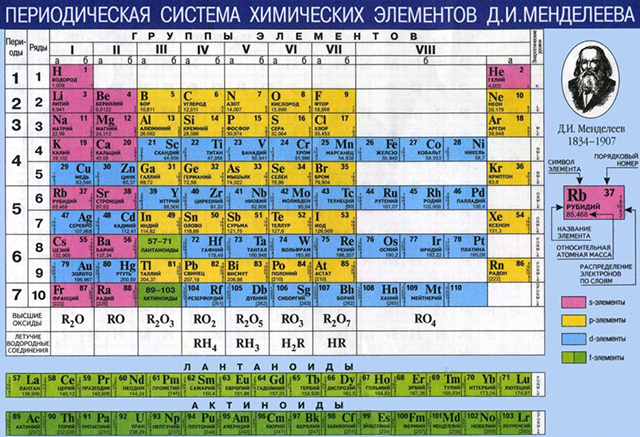
Блок 1. Вещество Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента Периодический закон Д. И. Менделеева стал базой для создания ученым Периодической системы химических элементов. Она представлена 7 периодами и 8 группами.
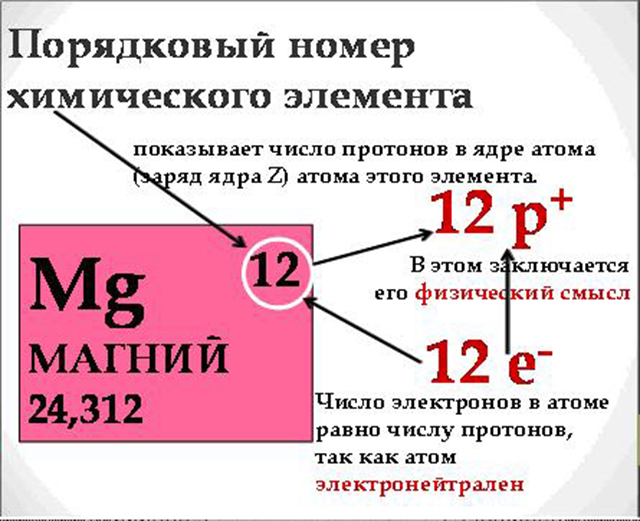
Периодами называются горизонтальные ряды таблицы, которые делятся на малые и большие. 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды) находятся в малых периодах, а в больших периодах находятся 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й период), 7-й период пока остается незавершенным. Каждый период с типичного металла начинается и заканчивается типичным неметаллом и благородным газом. Группами элементов называются вертикальные столбцы. Каждая группа представлена двумя подгруппами – главной и побочной. Подгруппой называется совокупность элементов, которые являются полными химическими аналогами; часто элементы подгруппы имеют высшую степень окисления, соответствующую номеру группы. Например, высшая степень окисления (+ II) отвечает элементам подгруппы бериллия и цинка (главная и побочная подгруппы II группы), а элементам подгруппы азота и ванадия (V группа) отвечает высшая степень окисления (+ V). Химические свойства элементов в главных подгруппах могут меняться от неметаллических до металлических (в главной подгруппе V группы азот – неметалл, а висмут – метал) – в широком диапазоне. Свойства элементов в побочных подгруппах меняются, но не столь резко; например, элементы побочной группы IV группы – цирконий, титан, гафний – очень похожи по своим свойствам (особенно цирконий и гафний). В Периодической системе в I группе (Li – Fr), II (Mg – Ra) и III (In, Tl) расположены типичные металлы. Неметаллы расположены в группах VII (F – At), VI (O – Te), V (N – As), IV (C, Si) и III (B). Некоторые элементы главных групп (Be, Al, Ge, Sb, Po), а также многие элементы побочных групп могут проявлять и металлические, и неметаллические свойства. Это явление получило название амфотерности. Для некоторых главных групп применяют групповые названия: VIII (Не – Rn) – благородные газы, VII (F – At) – галогены, IV (О – Ро) – халькогены, II (Са – Ra) – щелочноземельные металлы, I (Li – Fr) – щелочные металлы.
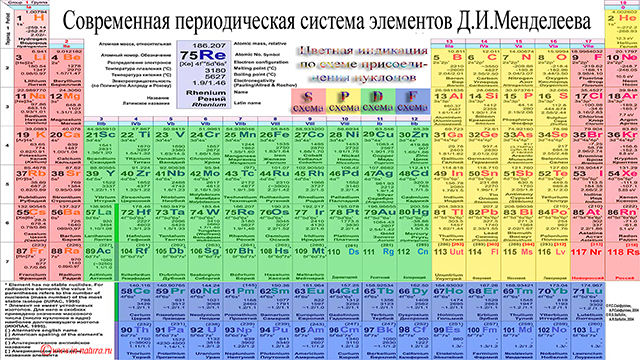
Форма Периодической системы, которую предложил Д. И. Менделеев, получила название короткопериодной, или классической. В современной химии все шире используется другая форма – длиннопериодная, в которой все периоды – малые и большие – вытянуты в длинные ряды, начинающиеся щелочным металлом и заканчивающиеся благородным газом. Периодический закон Д. И. Менделеева и Периодическая система элементов Д.И. Менделеева стали основой современной химии.
|
|
|


| Лотоцкая Елена © 2024 | Сайт создан в системе uCoz
Некоторые файлы и информация, находящиеся на данном сайте, были найдены в сети ИНТЕРНЕТ, как свободно распространяемые, присланы пользователями сайта или найдены в альтернативных источниках, также использованы собственные материалы. Автор сайта не претендует на авторство ВСЕХ материалов. Если Вы являетесь правообладателем той или иной продукции или информации, и условия, на которых она представлена на данном ресурсе, не соответствуют действительности, просьба немедленно сообщить с целью устранения правонарушения. |
 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход Поиск
Поиск