Блок 1. Вещество
Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая
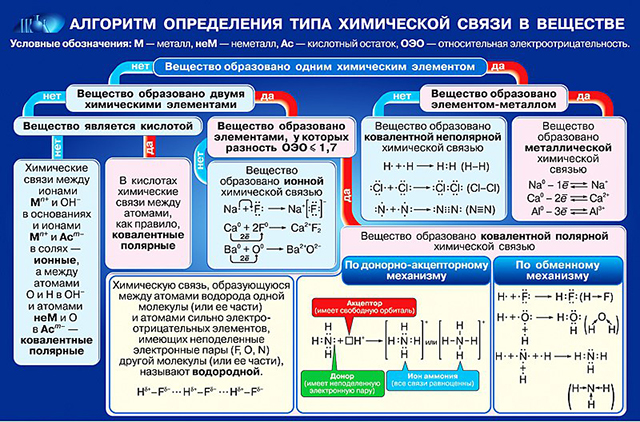
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами.

ХАРАКТЕРИСТИКИ СВЯЗЕЙ
ЭНЕРГИЯ СВЯЗИ
мерой прочности связи служит энергия, затрачиваемая на разрушение связи. Чем больше длина связи, тем меньше энергия.
ДЛИНА СВЯЗИ (НМ)
расстояние между ядрами в том или ином соединении, зависит от количества электронных уровней у каждого элемента
ПОЛЯРНОСТЬ МОЛЕКУЛЫ
определяется разностью электроотрицательностей атомов.
Чем больше разность электроотрицательностей (чем дальше элементы друг от друга) , тем больше полярность связи
От данных характеристик зависит тип связи.
Ковалентная связь
СВЯЗЬ МЕЖДУ АТОМАМИ НЕМЕТАЛЛОВ В РЕЗУЛЬТАТЕ ПЕРЕКРЫВАНИЯ ЭЛЕКТРОННЫХ ОБЛАКОВ
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ
Образуют атомы с одинаковой электроотрицательностью, чаще атомы одного и того же химического элемента (неметалла)
МЕХАНИЗМ ОБРАЗОВАНИЯ СВЯЗИ
Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
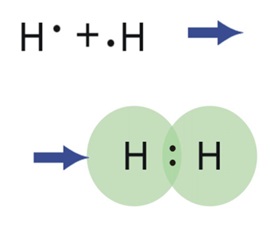 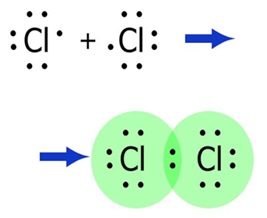
ПРИМЕРЫ НЕПОЛЯРНОЙ КОВАЛЕНТНОЙ СВЯЗИ:
а) двухатомные простые вещества: H–H, F–F,
б) симметричные молекулы типа Н2О2 ( Н-О-О-Н) – связь между двумя атомами кислорода и т.п.
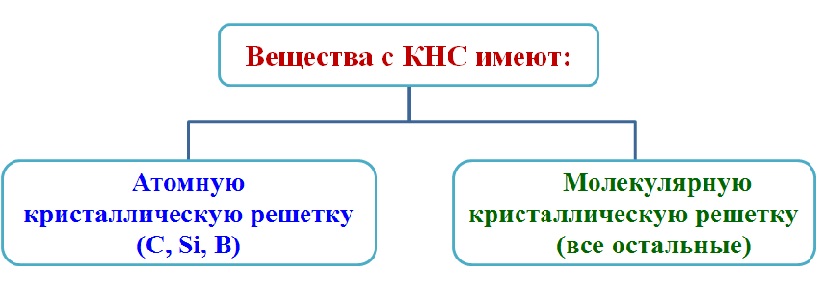
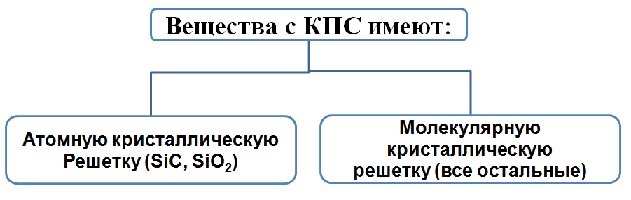
Свойства веществ с атомной кристаллической решеткой:
Твердые
Имеют высокие температуры плавления
Свойства веществ с молекулярной кристаллической решеткой:
При обычных условиях вещества газообразные (H₂, O₂), жидкие (Br₂), твердые (I₂)
Большинство веществ сильно летучие, т. е. имеют низкие to кипения и плавления
Растворы и расплавы не проводят электрический ток.
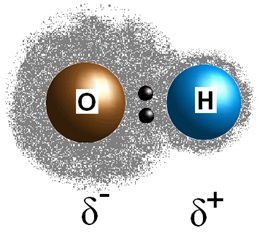
КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ
Образуют атомы неметаллов с разной электротрицательностью.
Самый электроотрицательный элемент – F
МЕХАНИЗМ ОБРАЗОВАНИЯ СВЯЗИ
Образуются общие электронные пары.
Общая электронная пара смещена к более электроотрицательному элементу.
МЕХАНИЗМЫ ОБРАЗОВАНИЯ ОБЩЕЙ ЭЛЕКТРОННОЙ ПАРЫ:
1. ОБМЕННЫЙ МЕХАНИЗМ
каждый из взаимодействующих атомов предоставляет в пару по одному электрону,
2. ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ
один из атомов предоставляет электронную ПАРУ, а другой – пустую (вакантную) орбиталь.
ПО ДОНОРНО-АКЦЕПТОРНОМУ МЕХАНИЗМУ образованы связи в следующих веществах:
1. Все комплексные соединения, например: K3[Al(OH)6]
2. Соли аммония и аминов: NH4Cl и т. п.
3. Азотная кислота, нитраты.
4. Газы СО- угарный газ, О3 – озон.
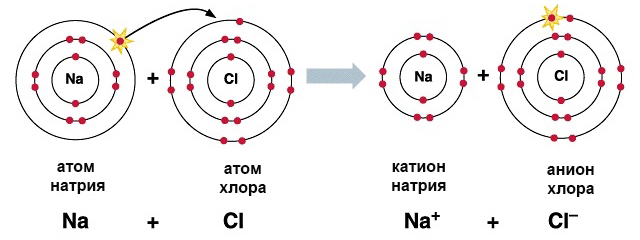
ИОННАЯ СВЯЗЬ
Между атомами металлов и неметаллов, т. е. между атомами резко отличающимися друг от друга по электроотрицательности
МЕХАНИЗМ ОБРАЗОВАНИЯ СВЯЗИ
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион)
Атом металла теряет электроны и превращается в катион (положительно заряженный ион)
ИОНЫ СВЯЗАНЫ ЭЛЕКТРОСТАТИЧЕСКИМИ СИЛАМИ
В ИОННОМ КРИСТАЛЛЕ НЕТ МОЛЕКУЛ.
Каждый ион окружен определенным числом ионов другого знака.
Ионная связь характеризуется ненаправленностью и ненасыщенностью.
Вещества с ионной связью имеют ионную кристаллическую решетку.
НЕОБХОДИМО ПОМНИТЬ, ЧТО СУЩЕСТВУЮТ ВЕЩЕСТВА, В МОЛЕКУЛЕ КОТОРЫХ ОДНОВРЕМЕННО ПРИСУТСТВУЮТ И ИОННЫЕ, И КОВАЛЕНТНЫЕ СВЯЗИ
(например, NaOH, KNO3).
Вещества с ионной связью образуют ионную кристаллическую решетку
Свойства веществ:
1.Все вещества при обычных условиях твердые
2.Имеют высокие температуры кипения и плавления
3.Расплавы и растворы проводят электрический ток
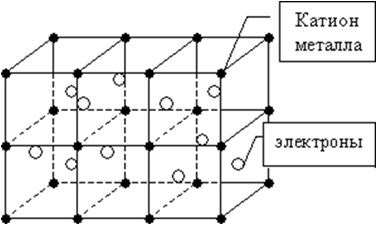
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
Атомы металлов слабо удерживают свои внешние электроны, поэтому эти электроны покидают свои атомы, превращая их в положительно заряженные ионы.
"Обобществленные" электроны передвигаются в пространстве между катионами металлов и удерживают их вместе.
СВОЙСТВА ВЕЩЕСТВ:
1. Металлический блеск
2. Пластичность
3. Ковкость
4. Электрическая проводимость
5. Теплопроводность
6. Твердость
| 


 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход Поиск
Поиск Друзья сайта
Друзья сайта Наш опрос
Наш опрос Статистика
Статистика










