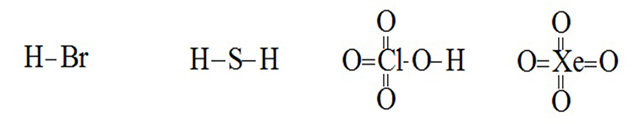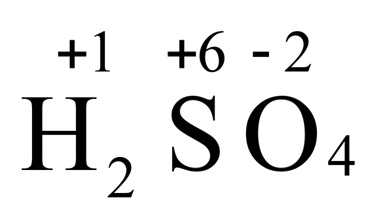Блок 1. Вещество
Валентность химических элементов. Степень окисления химических элементов
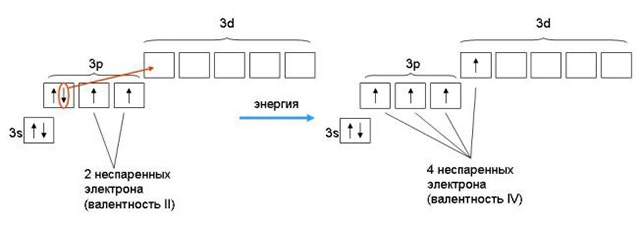
Валентность - это способность химических элементов к образованию химических связей;
Она определяет число химических связей, которыми данный атом соединен с другими атомами в молекуле
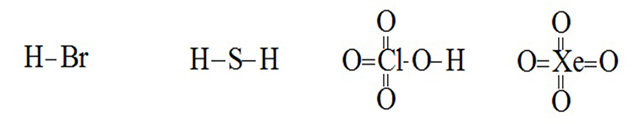
Валентные возможности определяются:
- числом неспаренных электронов
- наличием свободных орбиталей
- наличием неподеленных пар электронов
Валентность и степень окисления часто совпадают по цифровому значению, но это не одно и тоже.
Валентность не имеет знака и не может быть нулевой.
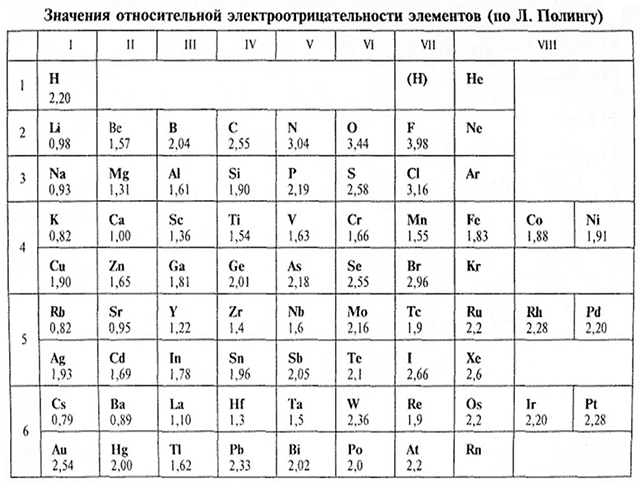
Электроотрицательность
Электроотрицательность - это свойство атомов одного элемента оттягивать на себя электроны от атомов других элементов в соединениях.
Наибольшее значение у фтора
Электроотрицательность лития условно принимается за единицу.
ЭО других элементов вычитается соответственноВ периодической системе слева направо.
По периоду электроотрицательность растет, по группе А сверху вниз уменьшается.
Степень окисления
Степень окисления - это условный заряд атомов, вычисленный из предположения, что вещество состоит только из ионов.
С.О. показывает, сколько электронов отдал или присоединил элемент.
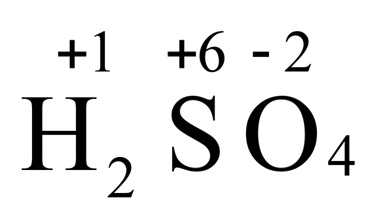
Правила для определения степени окисления
Степень окисления бывает:
- нулевая
- положительная
- отрицательная
1. Степень окисления простых веществ и свободных атомов всегда равна нулю (0):
О₂ Fe⁰ Cl₂⁰
2. У металлов степень окисления всегда положительна и равна номеру группы (для металлов главных подгрупп).
У металлов I группы А с.о. = +1
У металлов II группы А с.о .= +2
У металлов III группы А с.о. = +3
3. У атома водорода степень окисления равна +1
Н₂⁺¹О⁻²,
(Исключение - соединений с металлами (гидриды) - с.о. = -1)
Na⁺¹H⁻¹
4. У атома кислорода (О) в соединениях степень окисления равна -2, кроме соединений со фтором (+2) и пероксидов (-1)
О⁺²F₂⁻¹ Н₂⁺¹О₂⁻¹
5. Степень окисления фтора (F) в соединениях всегда равна -1
6. В бескислородных бинарных соединениях степень окисления окислителя равна -(8 - номер группы)
Н2S S -(8-6)=-2
7. Суммарная степень окисления в молекуле всегда равна 0
Na2⁺¹O⁻² Al⁺³Cl3⁻¹ Ba⁺²H2⁻¹
Благородные (инертные газы) могут иметь степень окисления 0 и +8/
Высшая степень окисления всех элементов равна номеру группы
Исключение:
1) азот, кислород, фтор;
2)инертные газы – гелий, неон, аргон;
3) металлы побочных подгрупп первой (кроме меди) и VIIIB группы (второй и третий элемент «триады»).
Низшая степень окисления неметаллов равна –(8-номер группы).
Промежуточные степени окисления неметаллов определяются по числу распадающихся электронных пар.
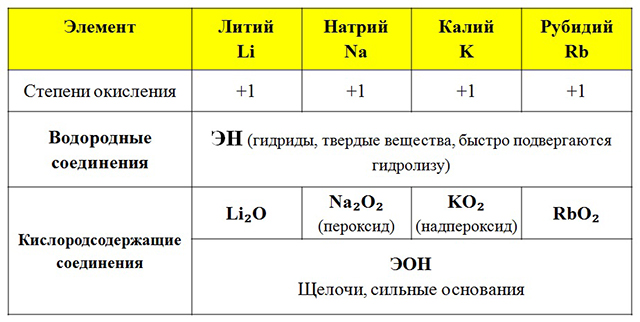
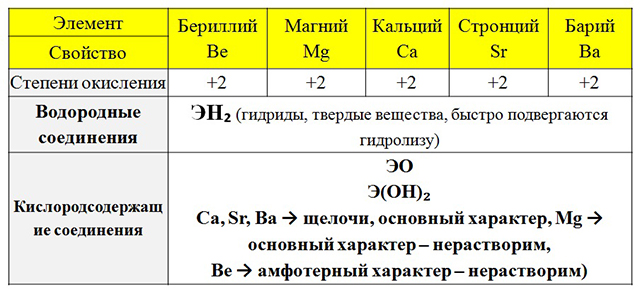
Степени окисления и свойства соединений основных элементов
  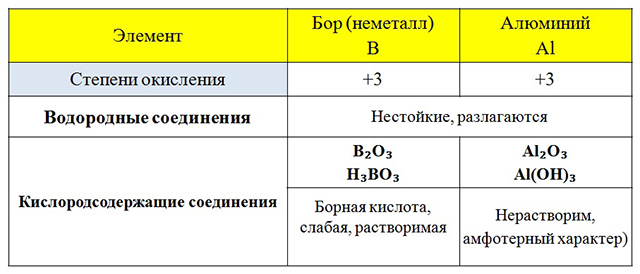 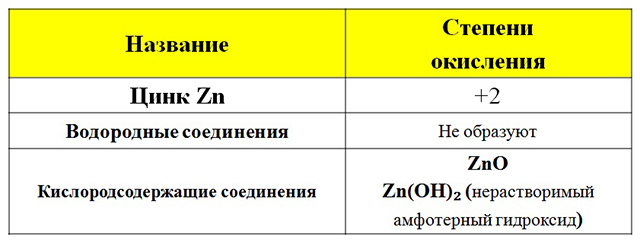 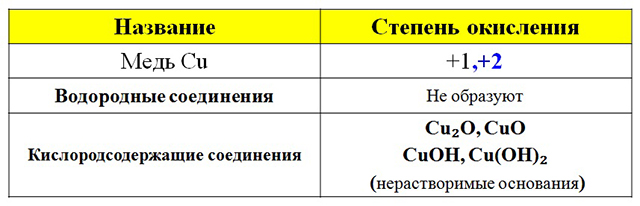 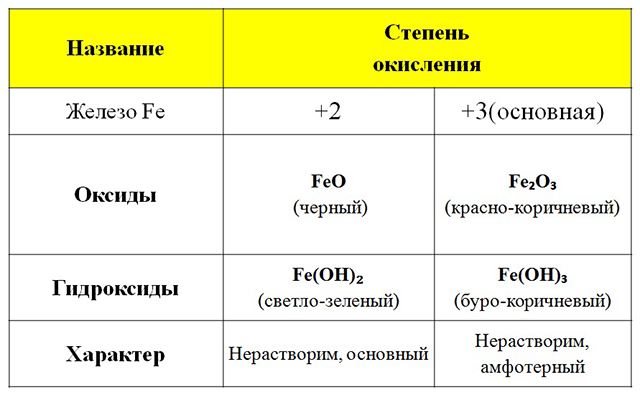 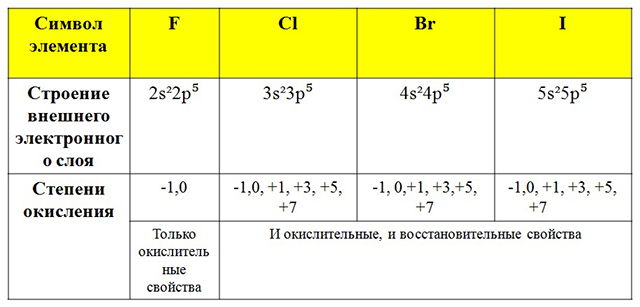 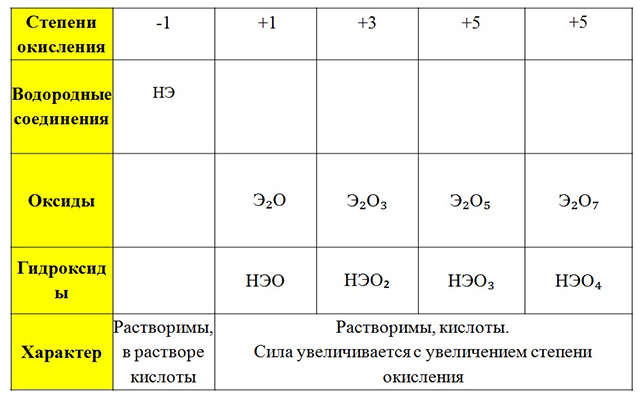 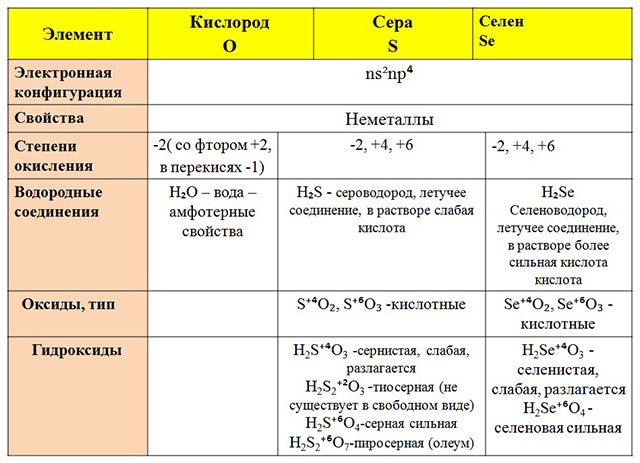 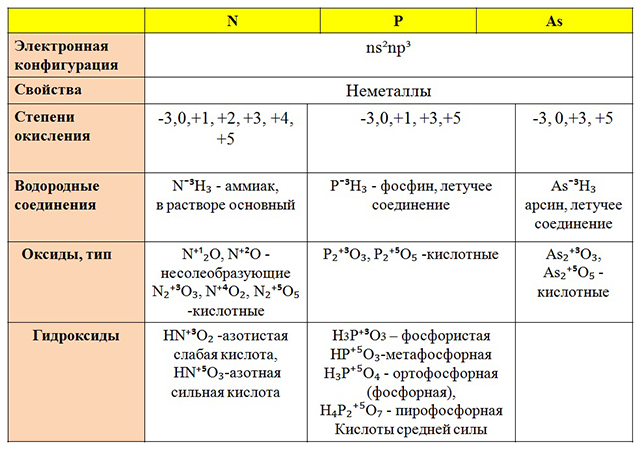
| 


 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход Поиск
Поиск Друзья сайта
Друзья сайта Наш опрос
Наш опрос Статистика
Статистика