Блок 3. Металлы. Неметаллы. Основные классы неорганических соединений
Химические свойства простых веществ-металлов
Металлы (от лат. metallum – шахта, рудник): группа элементов, обладающая характерными металлическими свойствами.
СТРОЕНИЕ АТОМА
Металлы имеют большой атомный радиус и малое число электронов (от 1 до 3) на внешнем слое.
Исключение:
Ge, Sn, Pb ─ 4 электрона;
Sb, Bi ─ 5 электронов;
Po ─ 6 электронов
Ме – одноатомны: K, Fe, Zn и т.д.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
1. Металлическая кристаллическая решетка – наличие подвижных электронов
2. Металлический блеск (неметаллы йод и углерод в виде графита) Наиболее хорошо: алюминий, серебро, палладий и родий.
3. Твёрдое состояние (кроме ртути ).Обладают различной твёрдостью: щелочные металлы режутся ножом, а ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло.
4. Пластичность - возможность лёгкой механической обработки. Самыми пластичными являются золото, серебро и медь , германий и висмут непластичны.
5. Высокая теплопроводность и электропроводимость обусловлена наличием подвижных электронов. Серебро, медь и алюминий имеют наибольшую электропроводность.
6. Высокая плотность. Металлы делят на: лёгкие (плотность 0,53 ÷ 5 г/см³). Самый лёгкий литий (плотность 0.53 г/см³).тяжёлые (5 ÷ 22,5 г/см³). Самые тяжёлые металлы осмий и иридий (около 22.6 г/см³).
7. Температура плавления лежит в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам).
МЕТАЛЛЫ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (А) (ЩЕЛОЧНЫЕ МЕТАЛЛЫ): литий, натрий, калий, рубидий, цезий, франций.
Мягкие металлы, легко режутся ножом. На срезе белого цвета с блеском, исчезающим на воздухе.
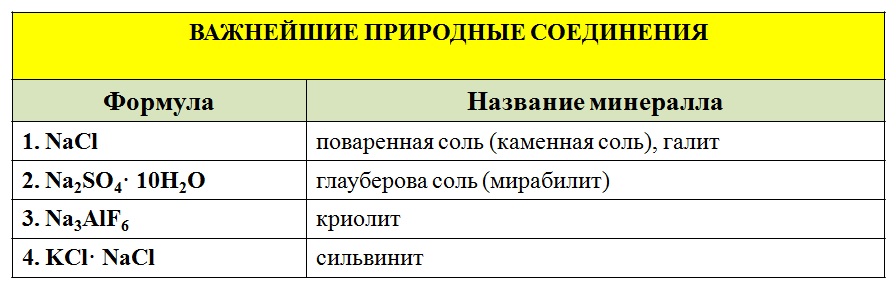 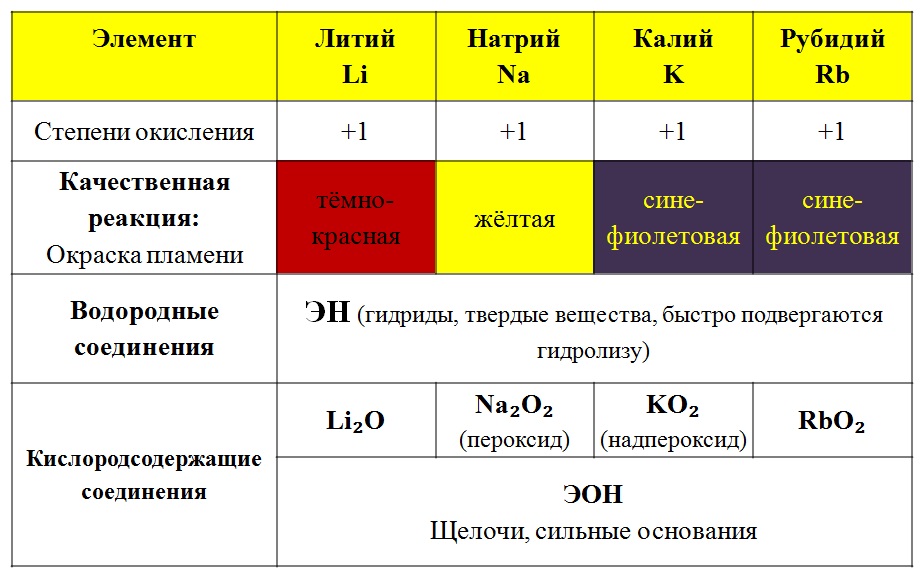
МЕТАЛЛЫ II ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (А): бериллий, магний, кальций, стронций, барий, радий
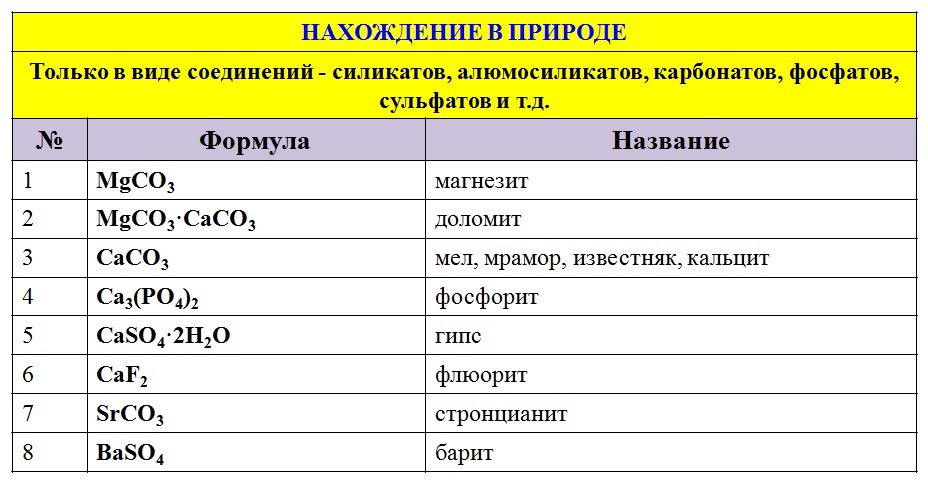 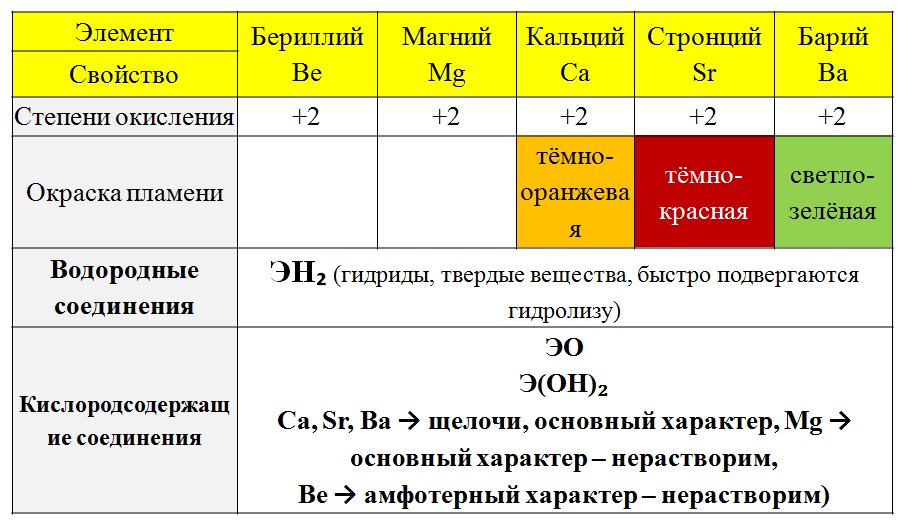
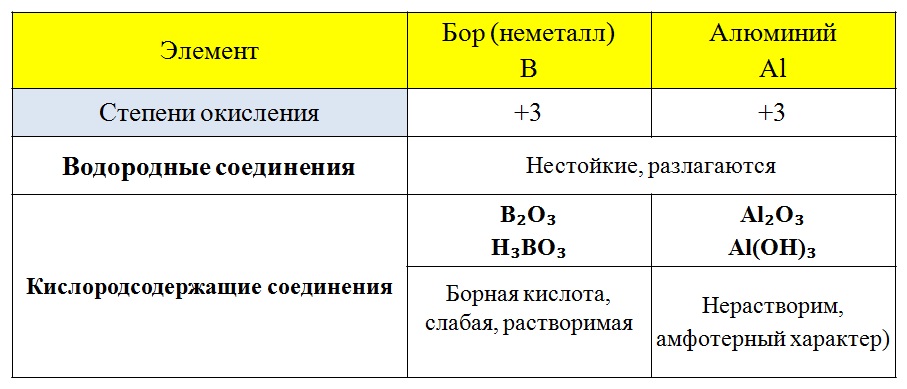
АЛЮМИНИЙ И ЭЛЕМЕНТЫ III-A ГРУППЫ
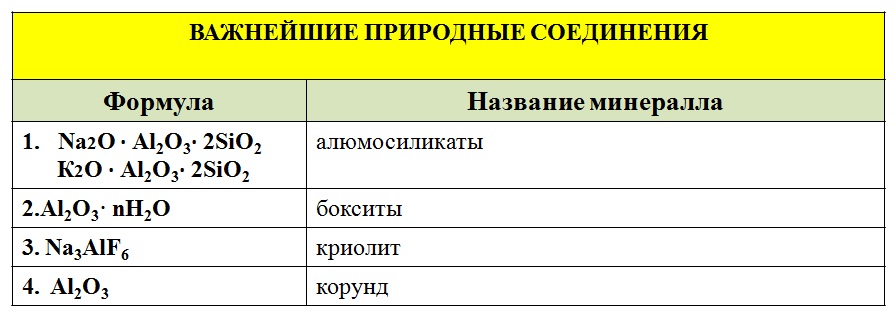 
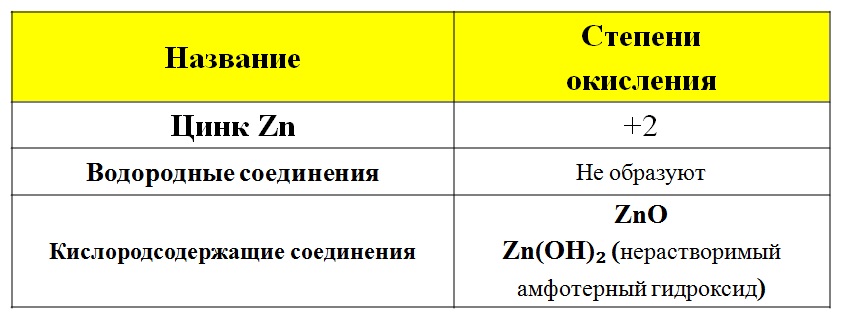
Цинк — элемент побочной подгруппы второй группы (А), четвёртого периода, не входит в число переходных элементов.
Хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Минералы цинка - сфалерит, или цинковая обманка ZnS (разнообразные примеси придают всевозможные цвета) .
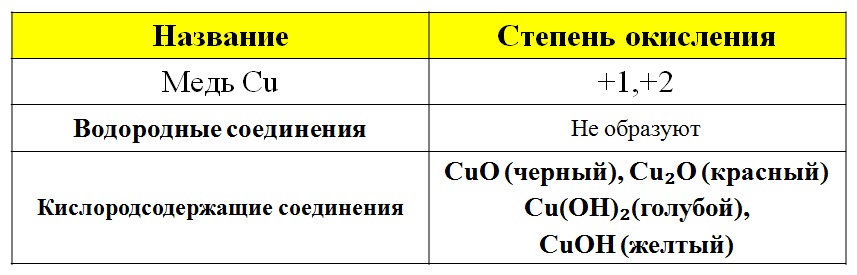
Медь — элемент побочной подгруппы первой группы (А), четвёртого периода. Электронное строение: 3d¹⁰4s¹. ПРОВАЛ ЭЛЕКТРОНА!
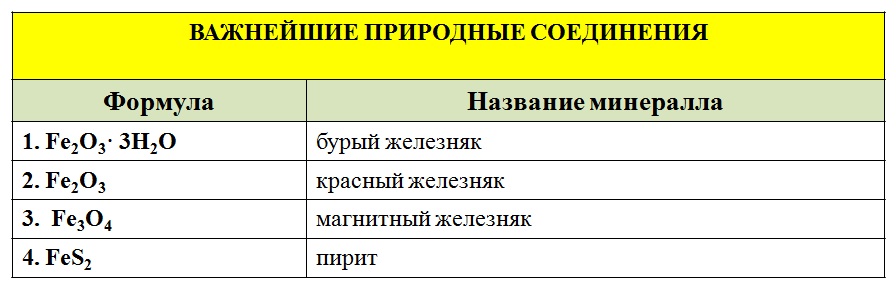
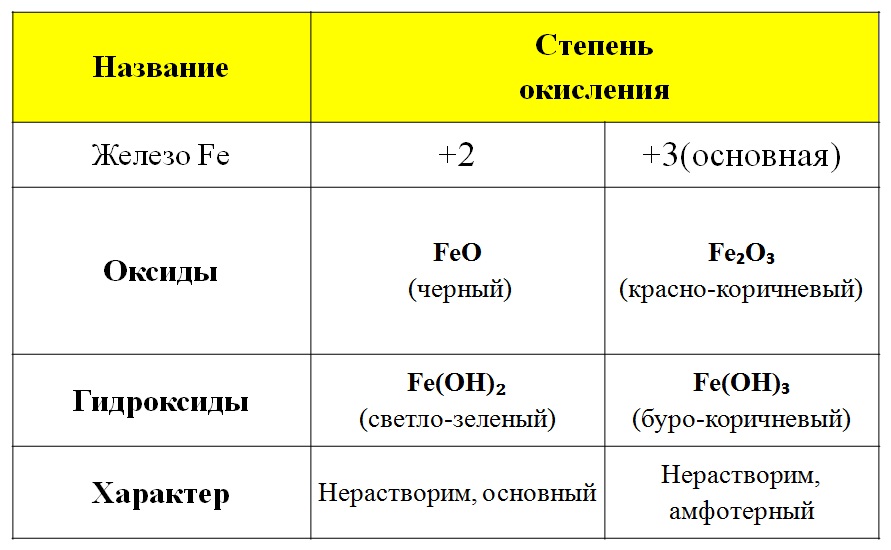
Железо - металл 4 группы 8 группы побочной подгруппы.
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
По химическим свойствам металлы подразделяют на:
1)Активные (щелочные и щелчноземельные металлы, Mg, Al, Zn и др.)
2) Металлы средней активности (Fe, Cr, Mn и др.) ;
3)Малоактивные (Cu, Ag)
4) Благородные металлы – Au, Pt, Pd и др.
В реакциях - только восстановители.
Атомы металлов легко отдают электроны внешнего (а некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы.
Возможные степени окисления Ме
Низшая 0,+1,+2,+3
Высшая +4,+5,+6,+7,+8
1. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С НЕМЕТАЛЛАМИ
С ВОДОРОДОМ
Реагируют при нагревании металлы IA и IIA группы, кроме бериллия.
Образуются твёрдые нестойкие вещества гидриды, остальные металлы не реагируют.
2K + H₂ = 2KH (гидрид калия)
Ca + H₂ = CaH₂
С КИСЛОРОДОМ
Реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив.
Щелочные металлы при нормальных условиях образуют оксиды, пероксиды, надпероксиды (литий – оксид, натрий – пероксид, калий, цезий, рубидий – надпероксид)
4Li + O2 = 2Li2O (оксид)
2Na + O2 = Na2O2 (пероксид)
K+O2=KO2 (надпероксид)
Остальные металлы главных подрупп при нормальных условиях образуют оксиды со степенью окисления, равной номеру группы
2Сa+O2=2СaO
Металлы побочных подрупп образуют оксиды при нормальных условиях и при нагревании оксиды разной степени окисления, а железо железную окалину Fe3O4 (Fe⁺²O∙Fe2⁺³O3)
3Fe + 2O2 = Fe3O4
4Cu + O₂ = 2Cu₂⁺¹O (красный) 2Cu + O₂ = 2Cu⁺²O (чѐрный);
2Zn + O₂ = ZnO
4Cr + 3О2 = 2Cr2О3
С ГАЛОГЕНАМИ – галогениды (фториды, хлориды, бромиды, иодиды).
Щелочные при нормальных условиях с F, Cl , Br воспламеняются:
2Na + Cl2 = 2NaCl (хлорид)
Щелочноземельные и алюминий реагируют при нормальных условиях:
Сa+Cl2=СaCl2
2Al+3Cl2 = 2AlCl3
Металлы побочных подгрупп при повышенных температурах
Cu + Cl₂ = Cu⁺²Cl₂
Zn + Cl₂ = ZnCl₂
2Fe + 3С12 = 2Fe⁺³Cl3 хлорид железа (+3)
2Cr + 3Br2 = 2Cr⁺³Br3
2Cu + I₂ = 2Cu⁺¹I (не бывает йодида меди (+2)!)
ВЗАИМОДЕЙСТВИЕ С СЕРОЙ при нагревании даже у щелочных металлов, с ртутью при нормальных условиях. Реагируют все металлы, кроме золота и платины.
с серой – сульфиды:
2K + S = K2S 2Li+S = Li2S (сульфид)
Сa+S = СaS (сульфид) 2Al+3S = Al2S3
Cu + S = Cu⁺²S (чѐрный) Zn + S = ZnS
2Cr + 3S = Cr2⁺³S3 Fe + S = Fe⁺²S
ВЗАИМОДЕЙСТВИЕ С ФОСФОРОМ И АЗОТОМ протекает при нагревании (исключение: литий с азотом при нормальных условиях):
с фосфором – фосфиды: 3Ca + 2P =Са3P2,
С азотом – нитриды 6Li + N2 = 3Li2N (нитрид лития) (н.у.)
3Mg + N2 = Mg3N2 (нитрид магния)
2Al + N2 = 2A1N
2Cr + N2 = 2CrN
3Fe + N2 = Fe₃⁺²N₂¯³
ВЗАИМОДЕЙСТВИЕ С УГЛЕРОДОМ И КРЕМНИЕМ протекает при нагревании:
С углеродом образуются карбиды
С углеродом реагируют только наиболее активные металлы.
Из щелочных металлов карбиды образуют литий и натрий, калий, рубидий, цезий не взаимодействуют с углеродом:
2Li + 2C = Li2C2,
Са + 2С = СаС2
Металлы – d-элементы образуют с углеродом соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
с кремнием – силициды: 4Cs + Si = Cs4Si,
2. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ
С водой реагируют металлы, стоящие до водорода в электрохимическом ряду напряжений
Щелочные и щелочноземельные металлы реагируют с водой без нагревания , образуя растворимые гидроксиды( щелочи ) и водород, алюминий (после разрушения оксидной пленки - амальгирование),
магний при нагревании, образуют нерастворимые основания и водород.
2Na + 2HOH = 2NaOH + H2↑
Сa + 2HOH = Ca(OH)2 + H2↑
2Аl + 6Н2O = 2Аl(ОН)3 + 3Н2↑
Остальные металлы реагируют с водой только в раскаленном состоянии, образуя оксиды (железо – железную окалину)
Zn + Н2O = ZnO + H2 ↑ 3Fe + 4HOH = Fe3O4 + 4H2↑
2Cr + 3H₂O = Cr₂O₃ + 3H₂↑

3. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С КИСЛОРОДОМ И ВОДОЙ
На воздухе железо и хром легко окисляется в присутствии влаги (ржавление):
4Fe + 3O2 + 6H2O = 4Fe(OH)3
4Cr + 3O2 + 6H2O = 4Cr(OH)3
4. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ОКСИДАМИ
(оксидами неметаллов и менее активных металлов)
Металлы (Al, Mg,Са ), восстанавливают при высокой температуре неметаллы или менее активные металлы из их оксидов → неметалл или малоактивный металл и оксид (кальцийтермия, магнийтермия, алюминотермия)
2Al + Cr2O3 = 2Cr + Al2O3
ЗСа + Cr₂O₃ = ЗСаО + 2Cr (800 °C)
8Al+3Fe3O4 = 4Al2O3+9Fe (термит)
2Mg + CО2 = 2MgO + С Mg + N2O = MgO + N2↑
Zn + CО2 = ZnO+ CO 2Cu + 2NO = 2CuO + N2↑
3Zn + SО2 = ZnS + 2ZnO
Металлы железо и хром реагируют со оксидами, уменьшая степень окисления
Cr + Cr2⁺³O3 = 3Cr⁺²O
Fe+ Fe2⁺³O3 = 3Fe⁺²O
5. ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ (КРОМЕ HNO3 и Н2SО4 (конц.)
Металлы, стоящие в электрохимическом ряду напряжений металлов левее водорода, вытесняют его из разбавленных кислот → соль и водород.
Мg + 2НС1 = МgСl2 + Н2↑
Al + 2НС1 = Al⁺³Сl₃ + Н2↑
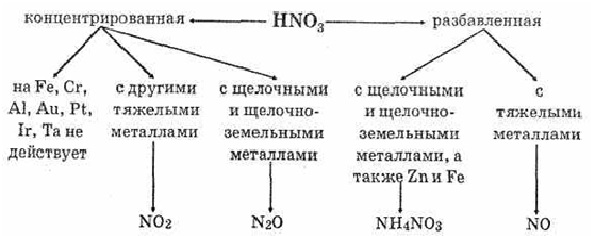
С концентрированной серной и азотной любой концентрации реакции идет по другому механизму
Металл + HNO₃ → соль + H₂O + …
Запомни! Азотная кислота никогда не выделяет водород при взаимодействии с металлами.
В качестве продуктов могут образовываться оксиды азота в разных степенях окисления, молекулярный азот, аммиак и соли аммония.
Металлы платиновой группы - золото, платина и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется концентрацией кислоты.
Общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
←увеличение концентрации кислоты
NO2,NO,N2O,N2,NH4NO3
→ увеличение активности металла
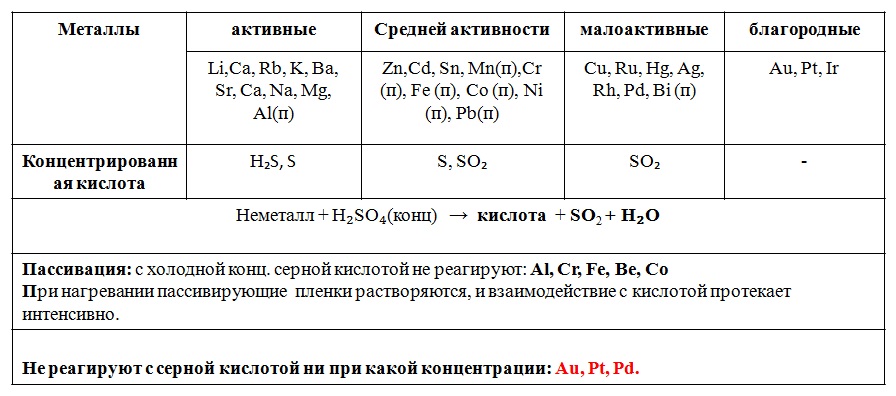
Пассивация: с холодной конц. серной кислотой не реагируют: Al, Cr, Fe, Be, Co
При нагревании пассивирующие пленки растворяются, и взаимодействие с кислотой протекает интенсивно.
Металл + H₂SO₄(конц) → соль + H₂O + …
6. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С СОЛЯМИ
Активные металлы вытесняют из солей менее активные.
Восстановление из растворов:
CuSO4 + Zn = Zn SO4 + Cu
FeSO4 + Cu =
Mg + CuCl2(pp) = MgCl2 + Сu
Восстановление металлов из расплавов их солей
3Na+ AlCl₃ = 3NaCl + Al
TiCl2 + 2Mg = MgCl2 +Ti
Металлы групп В реагируют с солями, понижая степень окисления.
2Fe⁺³Cl3 + Fe = 3Fe⁺²Cl2
7. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ СО ЩЕЛОЧАМИ
Со щелочами взаимодействуют только те металлы, оксиды и гидроксиды которых обладают амфотерными свойствами ((Zn, Al, Cr(III), Fe(III) и др.
РАСПЛАВ → соль металла + водород.
2NaOH + Zn → Na2ZnO2 + H2↑ (цинкат натрия)
2Al + 2(NaOH · H2O) = 2NaAlO2 + 3H2↑
РАСТВОР → комплексная соль металла + водород.
2NaOH + Zn0 + 2H2O = Na2[Zn+2(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
2Al+2NaOH + 6H2O = 2Na[Al(OH)4]+3H2↑ | 


 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход Поиск
Поиск Друзья сайта
Друзья сайта Наш опрос
Наш опрос Статистика
Статистика













