Блок 3. Металлы. Неметаллы. Основные классы неорганических соединений
Химические свойства оксидов: основных, кислотных, амфотерных
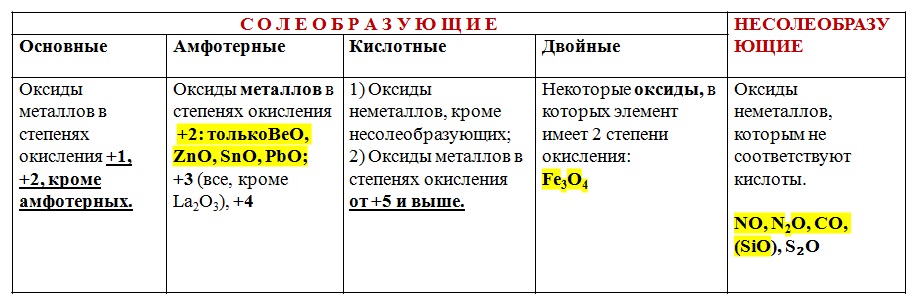
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + кислота (образуется соль + вода)
Кислоты должны существовать в виде раствора (не реагируют кремниевая, сероводородная, угольная)
Li2O + 2HCl= 2LiCl+ H2O,
NiO + H2SO4 = NiSO4 + H2O
2. Основный оксид + вода (образуется щелочь)
В реакцию вступают только 8 оксидов: IA группа, СаО, SrO, ВаО)
Оксид реагирует с водой только если в результате образуется растворимый гидроксид (щелочь).
Li2O + H2O = 2LiOH
BaO + H2O = Ba(OH)2
3. Основный оксид + кислотный оксид (образуется соль)
Соль должна быть устойчива.
BaO + CO2 = BaCO3,
FeO + SO3 = FeSO4,
CuO + N2O5 = Cu(NO3)2
СаО + SO2 = CaSO3
4. Реакции оснóвных оксидов с восстановителями.
Многие оснóвные оксиды могут быть восстановлены до металла более активным металлом или неметаллом-восстановителем
В качестве восстановителей используют: СО, С, водород, алюминий, магний.
С водородом реагируют оксиды неактивных металлов.
FeO + H2 = Fe + H2O (при нагревании)
Fe2O3 + H2 = 2FeO + H2O,
Fe2O3 + CO = 2FeO + CO2.
5. Окисление до более высоких степеней окисления.
Осуществима, если металл может иметь несколько оксидов с разными степенями окисления.
4FeO + O2 = 2Fe2O3
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
К кислотным оксидам относятся оксиды неметаллов и некоторые оксиды металлов групп Б, если металлы в этих оксидах находятся в высших степенях окисления (+4,+5,+6,+7) , например, CrO3, Mn2O7.
газы: СО2, N2O3, SO2, SeO2),
жидкости : Mn2O7
твердые вещества : B2O3, SiO2, N2O5, P4O6, P4O10, I2O5, CrO3).
1. Кислотный оксид + вода → кислота
Оксид реагирует с водой, если в результате образуется растворимый гидроксид.
Не реагирует с водой SiO2.
N2O3 + H2O = 2HNO2
SO2 + H2O = H2SO3
N2O5 + H2O = 2HNO3
SO3 + H2O = H2SO4
2. Кислотный оксид + основный оксид→ соль
Соль должна быть устойчива.
CO2 + CaO = CaCO3
P2O5 + 6FeO = 2Fe3(PO4)2 (при нагревании)
N2O5 + ZnO = Zn(NO3)2
3. Кислотный оксид + основание (щелочь) → соль + вода
Реакция возможна только со щелочами.
SO3, CrO3, N2O5, Cl2O7) реагирует и с нерастворимыми (слабыми) основаниями.
CO2 + Ca(OH)2 = CaCO3 + H2O
SiO2 + 2KOH = K2SiO3 + H2O (при нагревании),
SO3 + 2NaOH = Na2SO4 + H2O,
N2O5 + 2KOH = 2KNO3 + H2O.
4. Кислотный оксид + соль более летучей кислоты → соль + летучий оксид
Твёрдые, нелетучие оксиды (SiO2,P2O5) вытесняют из солей летучие.
SiO2 + K2CO3 = K2SiO3 + CO2
(при нагревании)
4. Окисление оксидов до более высокой степени окисления:
Для элементов, которые образуют несколько оксидов с разной степенью окисления
а) кислородом:
2СО + О2 = 2СО2
2SO2 + O2 ⇆ 2SO3
б) озоном:
NO + O3 = NO2 + O2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
К амфотерным оксидам относят ZnO, Al2O3, BeO, PbO, Fe2O3, Cr2O3 и некоторые другие оксиды.
Амфотерные оксиды обладают свойствами и оснóвных, и кислотных оксидов.
ОСНОВНЫЕ СВОЙСТВА
1. Оксид + кислота → соль + вода
Только с сильными кислотами
ZnO + 2HCl = ZnCl2 + H2O
Al2O3 + HNO3 = Al(NO3)3 +H2O
2. Кислотный оксид + амфотерный оксид→ соль
Соль должна быть устойчива
ZnO+ SiO2 = ZnSiO3
КИСЛОТНЫЕ СВОЙСТВА
1. При сплавлении с оксидами металлов образует соли, в которых амфотерный металл образует кислотный остаток :
ZnO + Na₂O = Na₂ZnO2.
2. Амфотерный оксид + раствор щелочи → раствор гидроксокомплекса
Al2O3 + KOH +H2O = K[Al(OH)4]
ZnO + NaOH + H2O = Na2[Zn(OH)4]
3. Амфотерный оксид + расплав щелочи → соль + вода
Реагируют с расплавами щелочей – образуя соли, при этом проявляют свойства кислотных оксидов.
Al2O3 + 2KOH = 2KAlO2 + H2O (при нагревании)
ZnO + 2KOH =K2ZnO2 + H2O (при нагревании)
Вещества, образуемые катионами амфотерных металлов в щелочной среде
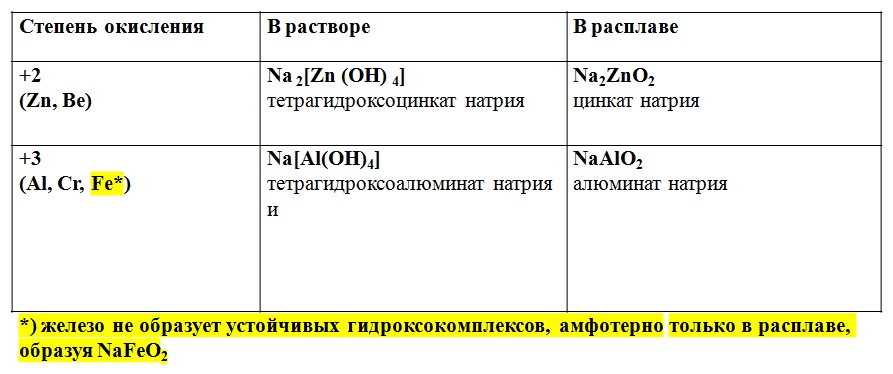
4. Амфотерный оксид + карбонаты щелочных металлов → соль + газ
При сплавлении могут взаимодействовать с карбонатами щелочных металлов, как со щелочами.
Al2O3 + Na2CO3 = 2NaAlO2 + CO2(при нагревании)
ZnO + Na2CO3 = Na2ZnO2 + CO2(при нагревании)
5. Взаимодействие с сильными восстановителями:
ZnO + C = Zn + CO;
ZnO + CO = Zn + CO2;
ZnO + H2 = Zn + H2O
Fe2O3 + H2 = 2FeO + H2O,
Fe2O3 + CO = 2FeO + CO2
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ МЕТАЛЛОВ
ОКСИДЫ МЕТАЛЛОВ II ГРУППЫ А - ОСНОВНЫЕ ОКСИДЫ:
MgO (жженная магнезия), CaO (негашёная известь, жжёная известь, кипелка. Порошок белого цвета), SrO. ВaО
Негашенная известь при спекании с углеродом дает карбид кальция
СаО + 3С = СаС2 + СО↑
III ГРУППА А ОКСИД АЛЮМИНИЯ Аl2О3 - АМФОТЕРНЫЙ
с преобладание основных свойств
Al2O3 - очень твердый белого цвета(корунд), тугоплавкий - 2050⁰С.
Реагирует с солями летучих кислотс образованием алюминатов и газообразного вещества.
Аl2O3 + Na2CO3 (тв.) = 2NaAlO2 + СO2↑
I ГРУППА Б
ОКСИДЫ МЕДИ
ОКСИД МЕДИ (I) твердое вещество красного цвета, нерастворимые в воде, имеют основный характер.
1. Взаимодействует с разбавленной серной кислотой с образование меди, сульфата меди (II), воды.
Cu2O + H2SO4 = Cu + CuSO4 + H2O
2. Взаимодействует с водным растворoм аммиака с образованием гидроксида диамин меди.
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2OH]
ОКСИД МЕДИ (II) твердое вещество черного цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
CuO + NaOH + H2O = Na2[Cu(OН)4] (тетрагидроксокупрат)
Восстанавливается при нагревании водородом, углеродом, угарным газом, аммиаком и более активными металлами
→ медь + соответствующий оксид или неметалл.
ЗСuО + 2NH3 = ЗСu + N2↑ + 3H2О
II ГРУППА Б
ОКСИД ЦИНКА
ОКСИД ЦИНКА (II) твердое вещество белого цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
ZnO + NaOH + H2O = Na2[Zn(OН)4] (тетрагидроксоцинкат)
VIII ГРУППА Б
ОКСИДЫ ЖЕЛЕЗА
ОКСИД ЖЕЛЕЗА (II) ОСНОВНЫЙ
порошок черного цвета, нерастворимый в воде.
обладают восстановительными свойствами, соединения железа со степенью окисления железа +2 малоустойчивы они легко превращаются в соединения железа (III) под действием окислителей:
3FeO + 10HNO3 = 3Fe(NO3)3 + NO↑ + 5H2O
Fe₂O₃ - ОКСИД ЖЕЛЕЗА (III) АМФОТЕРНЫЙ
Твердое вещество бурого цвета, нерастворимое в воде
Оксид образуется при сжигании сульфидов железа, например, при обжиге пирита:
4FeS₂ + 11O₂ → 2Fe₂O₃ + 8SO₂↑
или при прокаливании солей железа:
2FeSO₄ →Fe₂O₃ + SO₂↑ + SO₃↑
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ НЕМЕТАЛЛОВ
IV группа А ОКСИДЫ УГЛЕРОДА.
CO - НЕСОЛЕОБРАЗУЮЩИЙ
Угарный газ – бесцветный, без запаха, плохо растворим в воде, токсичен, ядовит
Молекула оксида углерода (II) имеет линейное строение. Между атомами углерода и кислорода образуется тройная связь, за счѐт дополнительной донорно-акцепторной связи.
CO2 -КИСЛОТНЫЙ
Углекислый газ – без цвета, без запаха, при сжижении образует «сухой лед»
Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
ОКСИД КРЕМНИЯ (IV) SIO2 – КИСЛОТНЫЙ оксид.
В природе – речной песок, кварц, кремнезем. Оксид без цвета, без запаха, единственный из кислотных нерастворимый в воде.
Имеет атомную кристаллическую решетку.
1) Из кислот реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 6HF(г) = SiF4 + H2O
SiO2 + 6HF(р-р)= H2[SiF6] + 2H2O
2) При температуре выше 1000 °С реагирует с активными металлами, при этом\nобразуется кремний:
SiO2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды:
SiO2 + 4Mg = Mg2Si + 2MgO.
3) Взаимодействие с неметаллами.
с водородом: SiO2 + 2Н2 = Si + 2Н2O,
с углеродом: SiO2 + 3С = SiС + 2СO.
V ГРУППА А ОКСИДЫ АЗОТА
N₂O ОКСИД АЗОТА (I) ЗАКИСЬ АЗОТА, "веселящий газ“ НЕСОЛЕОБРАЗУЮЩИЙ
Бесцветный газ, со слабым сладковатым запахом, хорошо растворим в воде.
Разлагается при 700°C с выделением кислорода:
2N2O = 2N2+ O2
2. Окислитель, поддерживает горение, как кислород.
С водородом: N2O + H2 = N2 + Н2O,
с углеродом: N2O + C = N2 + CO
с фосфором: 5N2O + 2Р = 5N2 + Р2O5
NO ОКСИД АЗОТА (II) ОКИСЬ АЗОТА НЕСОЛЕОБРАЗУЮЩИЙ
бесцветный газ, без запаха, плохо растворим в воде.
Легко окисляется кислородом и галогенами
2NO + O2 = 2NO2
Может быть окислителем, переходя в простое вещество азот: в нѐм могут гореть водород, углерод и т.п.
2NO + 2H2 =N2 + 2H2O
NO2 ОКСИД АЗОТА (IV), ДИОКСИД АЗОТА, «ЛИСИЙ ХВОСТ» КИСЛОТНЫЙ
бурый газ, специфический запах, токсичен, взаимодействует с водой - (даѐт 2 кислоты)
1. Кислотный оксид, образует с водой сразу две кислоты: азотную и азотистую:
2NO2 + H2O = HNO3 + HNO2
4NO2 + 2H2O + O2 = 4HNO3
2) со щелочами:
2NO2 +2NaOH =NaNO2+NaNO3 +H2O
2. Окислитель:
NO2 + SO2 = SO3 + NO
2NO2 + 2С = 2СO2 + N2
5NO2 + 2Р = Р2O5 + 5NO
N2O5 ОКСИД АЗОТА (V) АЗОТНЫЙ АНГИДРИД КИСЛОТНЫЙ
кристаллическое вещество, легко плавится (40°С)
1. Сильный окислитель:
2N2O5 + S = SO2 +4NO2
2. Легко разлагается (при нагревании – со взрывом):
2N2O5 = 4NO2 + O2
P2O5 (ОКСИД ФОСФОРА (V) ФОСФОРНЫЙ АНГИДРИД). КИСЛОТНЫЙ
Белые кристаллы. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Реакция с водой – в зависимости от количества воды – образуются разные кислоты
P2O5 + H2O = 2HPO3 (метафосфорная кислота)
P2O5 +3H2O = 2H3PO4 (ортофосфорная кислота)
VI ГРУППА А ОКСИДЫ СЕРЫ
SO2 (СЕРНИСТЫЙ АНГИДРИД; СЕРНИСТЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветный газ с резким запахом, хорошо растворимый в воде. Обладает восстановительными и окислительными свойствами
SO3 (СЕРНЫЙ АНГИДРИД; СЕРНЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветная жидкость с резким запахом, хорошо растворима в воде. Обладает сильными окислительными свойствами
Взаимодействует с концентрированной серной кислотой, образуя олеум.
VII ГРУППА А ОКСИДЫ ГАЛОГЕНОВ

ФТОРИД КИСЛОРОДА ОF2
Кислород проявляет положительную степень окисления. Бесцветный газ, плохо растворимый в воде, распадается на кислород и фтор.
Фтор не образует кислородных кислот, так как не проявляет положительных степеней окисления. | 


 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход Поиск
Поиск Друзья сайта
Друзья сайта Наш опрос
Наш опрос Статистика
Статистика



