Блок 3. Металлы. Неметаллы. Основные классы неорганических соединений
Химические свойства оснований и кислот
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
Основания – сложные вещества, содержащие в своем составе гидроксид-ионы (-ОН).
Разделяются на растворимые и нерастворимые в воде основания.
Растворимые основания (щелочи) в водном растворе диссоциируют на ионы.
KOH = K+ + OH-
Нерастворимые основания в водном растворе на ионы не распадаются!

ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧЕЙ
1.Меняют цвет индикаторов:
Фенолфталеин (бесцветный) →малиновый
Метиловый оранжевый→жёлтый
Лакмус (фиолетовый) → синий
2. Щёлочь + кислота→ соль + Н₂О (исключение H₂SiO₃).
Избыток кислоты → кислая соль, избыток щелочи → средняя)
КОН + H₂SO₄ → KНSO₄ + 2H₂O
2КОН + H₂SO₄ → K₂SO₄ + 2H₂O
3. С кислотными оксидами → кислые и средние соли
избыток щелочи → средняя, избыток оксида → кислая)
SiO2(тв.)+ 2NaOH = Na2SiO3 + +H2O
2NaOH (избыток) + CO2 = Na2CO3 + H2O(средняя соль)
NaOH+ CO2(избыток) = NaНCO3 (кислая соль)
4. С растворами средних солей → соль + основание
Исходные вещества должны быть растворимы, в продуктах - газ или осадок.
2NaOH + FeSO4 = Fe(OH)2↓+ Na2SO4
2KOH + (NH4)2SO4 = K2SO4 + 2NH3↑+ 2H2O
5. Соль амфотерного металла со щелочью → гидроксид или гидроксокомплекс (в зависимости от количества щелочи)
AlCl3 + 3KOH(недостаток) = Al(OH)3↓ + 3KCl
AlCl3 + 4KOH(избыток) = 3KCl + K[Al(OH)4]
6. С кислыми солями → средняя соль.
NaOH + NaHCO3 = H2O + Na2CO3;
7. С амфотерными оксидами и гидроксидами → средняя соль (сплавление)+ H2O
2NaOH + Cr2O3 =2NaCrO2 + H2O
2NaOH +Zn(OH)2= Na2ZnO2 + 2H2O
в растворах → гидроксокомплекс.
2KOH + ZnO +H2O= K2[Zn(OH)4]
2NaOH +Zn(OH)2= Na2[Zn(OH)4]
8. С амфотерными металлами (кроме Fe и Cr) → средняя соль + H2↑ (сплавление)
2KOH + Zn(сплавление) = K2ZnO2 + H2↑
в растворах → гидроксокомплекс + H2↑
2NaOH + Zn +2H2O = Na2[Zn(OH)4] + H2↑
9. Щелочи (кроме LiOH) при нагревании не разлагаются.
2LiOH = Li2O + H2O
СВОЙСТВА НЕРАСТВОРИМЫХ ОСНОВАНИЙ
1. С сильными кислотами (реакция нейтрализации) → соль + H2O
(избыток основания → соль основная, кислоты → кислая)
Fe(OH)2+2HCl = FeCl2 + 2H2O
2. С кислотными оксидами (только сильных кислот – SO3,N2O5, Cl2O7) → соль + Н₂О
Cu(OH)2 + N2O5 = Cu(NO3)2 + Н₂О
3. Разложение при нагревании → оксид металла + H2O.
Сu(OH)2 = CuO + H2O
AgOH распадается сразу в момент получения.
4. Переход в более высокую степень окисления (переходные элементы)
4Cr(OH)2 + O2 + 2H2O = 4Cr(OH)3.
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ
– в зависимости от условий проявляют как кислотные, так и основные свойства (двойственный характер).
+2: Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2
+3: Al(OH)3, Cr(OH)3, Fe(OH)3
Fe(OH)3–слабо амфотерный, не образует гидроксокомплексов, реагирует со щелочами только в сплаве!
ОСНОВНЫЕ СВОЙСТВА
1. С сильными кислотами → соль + вода
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Al(OH)3+ 3HNO3 = Al(NO3)3 + 3H2O
2. С кислотными оксидами (только сильных кислот – SO3,N2O5, Cl2O7) → соль + Н₂О
Zn(OH)2 + N2O5 = Zn(NO3)2 + Н₂О
3. Разложение при нагревании → оксид металла + H2O.
Zn(OH)2 = ZnO + H2O
2Al(OH)3 = Al2O3 + 3H2O
КИСЛОТНЫЕ СВОЙСТВА
1. С расплавами щелочей → соль + вода
Al(OH)3 + KOH = KAlO2(алюминат)+ 2H2O
Zn(OH)2 +2KOH = K2ZnO2 + 2H2O
Цинкат калия
2. С растворами щелочей → гидроксокомплекс (кроме железа)
2NaOH+Zn(OH)2= Na2[Zn(OH)4]
Тетрагидроксоцинкат натрия.
3KOH+ Cr(OH)3 = K3[Cr(OH)6]
Гексагидроксохромат (III) калия
3. При сплавлении с карбонатами щелочных металлов → соль + CO2+ 3Н2О .
2Al(OH)3+ Na2CO3 = 2NaAlO2 + CO2+ 3Н2О
(алюминат натрия)
Zn(OH)2 + Na2CO3 = Na2ZnO2 + CO2 + Н2О
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
1.Меняют цвет индикатора:
Метиловый оранжевый →розовый
Лакмус фиолетовый →красный
Фенолфталеин бесцветный → бесцветный
2. С металлами до Н₂→соль + Н₂↑ (кроме азотной кислоты и серной концентрированной)
H₂SO₄ + Mg → MgSO₄ + H₂↑
Металл + HNO₃ → соль + H₂O + …
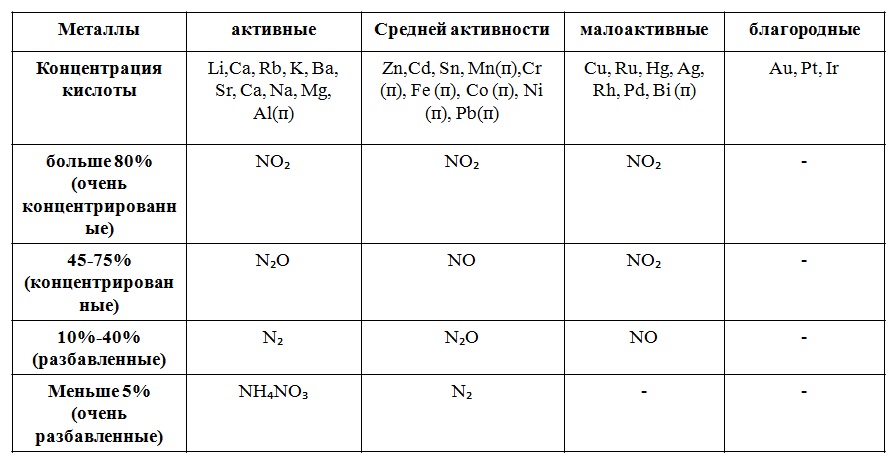
Золото и платина растворяются только в царской водке (один объем концентрированной (63%-ной) азотной кислоты и три объема концентрированной соляной кислоты), с образованием комплексных соединений золота и платины:
Аu + HNО3 + 4НСl = Н[АuСl4] + NO + 2Н2О
(Тетрахлороаурат(III) водорода (золотохлористоводородная кислота))
ЗРt + 4HNО3 + 18НС1 = ЗН2[РtС16] + 4NО + 8Н2О
(Тетрахлорплатинат(III) водорода (платинохлористоводородная кислота)
Металл + H₂SO₄(конц) → соль + H₂O + …
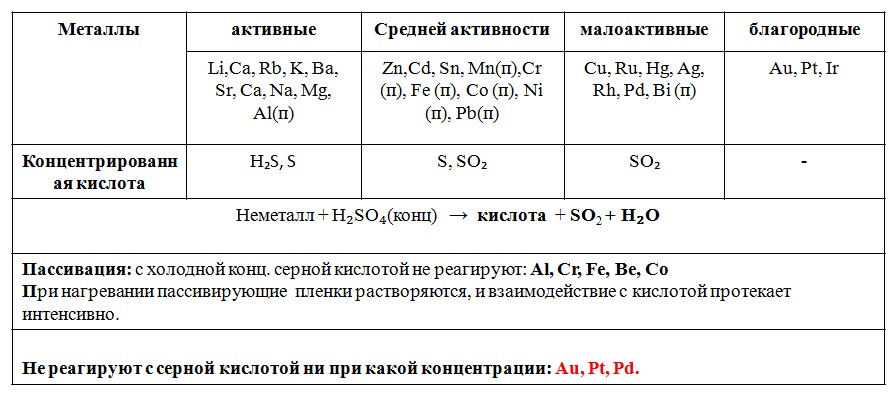
3.С оксидами металлов→ соль + Н₂О
Н₂SO₄ + MgO → MgSO₄ + H₂O
4.С основаниями → соль + H₂O
H₂SO₄ + Са(OH)₂ → СаSO₄ + 2H₂O
5.С растворами солей →соль + кислота (образуется осадок или газ)
Na₂CO₃ + H₂SO₄ → Na₂SO₄ + CO₂↑+ H₂O
ВЫТЕСНИТЕЛЬНЫЙ РЯД КИСЛОТ (ПО УБЫВАНИЮ):
H2SO4 → HCl и HNO3 → H3PO4 → H2SO3 → H2S → H2CO3 → H2SiO3
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ГИДРОКСИДОВ ГРУППЫ А
ГИДРОКСИДЫ V ГРУППЫ А
Азотистая Кислота HNO2 – слабая (проявляет окислительные и восстановительные свойства)
Азотная кислота HNO3 – сильная (сильный окислитель)
Азотистая кислота HNO2 разлагается при нагревании до кислоты, оксида и воды:
3HNO2 = HNO3 + 2NO + H2O
без нагревания до двух оксидов и воды:
2HNO2 = NO2 + NO + H2O
Азотная кислота HNO₃ разлагается на свету и при нагревании
4HNO3 = 2H2O + 4NO2 + O2
Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция")
С металлами → нитрат металла + H2O + (NO₂↑, NO↑, N₂O↑, N₂↑,NH₄NO₃)
никогда не выделяется водород!
Фосфорные кислоты
HPO3 - метафосфорная кислота
H3PO4 - ортофосфорная кислота
При нагревании ортофосфорная превращается в пирофосфорную кислоту.
ГИДРОКСИДЫ VI ГРУППЫ А
Сероводородная кислота H2S – слабая (проявляет восстановительные свойства)
Сернистая кислота H2SO₃ – слабая (окислитель и восстановитель)
Серная кислота H2SO₄ – сильная (сильный окислитель)
ГИДРОКСИДЫ VII ГРУППЫ А
Хлорная кислота (бромная) - HClO4 (HBrO4)
Фтороводородная кислота (плавиковая) - HF
Хлороводородная кислота (соляная) - HCl
Бромоводородная кислота - HBr
Иодоводородная кислота - HI
ХЛОРНАЯ КИСЛОТА HCl⁺⁷O4 очень сильная кислота и очень сильный окислитель.
1) При нагревании хлорная кислота и ее соли разлагаются:
4HClO4 = 4ClO2↑ + 3O2↑ + 2H2O
KClO4 = KCl + 2O2↑
2) Сильный окислитель:
HClO4 + C → CO2↑ + Cl2↑ + H2O
ХЛОРОВОДОРОД HCl¯
Бесцветный газ, хорошо растворим в воде.
Раствор в воде – сильная хлороводородная кислота.
HCl – сильный восстановитель:
Взаимодействие с нитратом серебра (нитрат серебра является реактивом на соляную кислоту и ее соли);
выпадет осадок белого цвета, который не растворяется в воде, ни в кислотах:
HCl + AgNO₃ → AgCl↓ + HNO3
2) Взаимодействие с окислителями (MnO2, KMnO, KClO3 и др.):
6HCl + KClO3 → KCl +3H2O + 3Cl2↑
ФТОРОВОДОРОД HF¯¹
Бесцветный газ, хорошо растворим в воде.
Раствор в воде – фтороводородная (плавиковая) кислота – средней силы. | 


 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход Поиск
Поиск Друзья сайта
Друзья сайта Наш опрос
Наш опрос Статистика
Статистика



