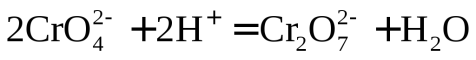Блок 1. Теоретические основы химии
1.2. Периодический закон и Периодическая система химических элементов Д. И. Менделеева
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д. И. Менделеева и особенностям строения их атомов
Понятие переходный элемент обычно используется для обозначения любого из d- или f-элементов. Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно.
Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей. Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные.
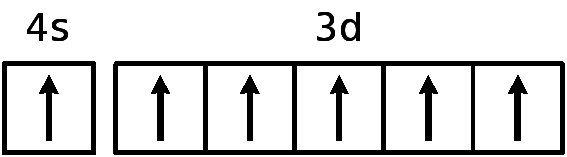
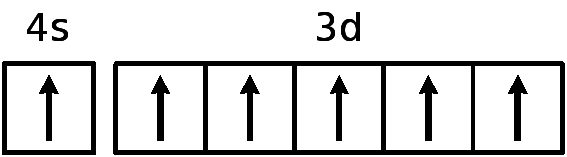
В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной.
Cr24 1s22s22p63s23p64s13d5
Для атома хрома электроно-графическая формула выглядит так:
Это явление называется проскок (провал) электрона.
В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра).
Cu29 1s22s22p63s23p64s13d10
Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы).
d-элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность к образованию комплексных ионов; образование окрашенных соединений.
d-элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
d-элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь.
Химические свойства
Электроотрицательность и энергии ионизации металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда постепенно ослабевают в указанном направлении. Такое изменение их свойств проявляется и в последовательном возрастании окислительно-восстановительных потенциалов с переходом от отрицательных к положительным значениям.
Хром — твердый голубовато-белый металл. При высоких температурах горит в кислороде с образованием Сr2О3, реагирует с парами воды
2Сr + 3H2O = Сr2O3 + 3H2↑
и с галогенами, образуя галогениды состава СrГ3. Хром (так же, как алюминий) пассивируется холодными концентрированными Н2SО4 и НNО3. Однако при сильном нагревании эти кислоты растворяют хром:
2Сr + 6H2SO4(конц) = Сr2(SO4)3 + 3SO2↑ + 6H2O,
Сr + 6НNО3(конц) = Сr(NО3)3 + 3NO2↑ + 3Н2О.
При обычной температуре хром растворяется в разбавленных кислотах (НСl, Н2SО4) с выделением водорода, образуя соли Сr2+. Обрабатывая их растворы щелочами, получают желтый осадок гидроксида хрома (II):
СrСl2 + 2 NaОН = Сr(ОН)2↓ + 2 NaСl.
Соли Cr3+ сходны с аналогичными солями алюминия. При действии щелочей на соли Сr3+ выпадает студнеобразный осадок гидроксида хрома (III) зеленого цвета:
Сr2(SО4)3 + 6 NaОН = 2 Сr(ОН)3↓ + 3 Na2SО4,
обладающий амфотерными свойствами. Он растворяется как в кислотах с образованием солей хрома (III)
2 Сr(OH)3 + 3 H2SO4 = Сr2(SO4)3 + 6 H2O,
так и в щелочах с образованием комплексной соли
Сr(ОН)3 + 3КОН = К3[Cr(ОН)6].
Наиболее важными соединениями хрома в высшей степени окисления +6 хромат калия К2СrО4 и дихромат калия К2Сr2О7.
В кислой среде ион CrO42- превращается в ион Сr2О72- . В щелочной среде эта реакция протекает в обратном направлении:
Железо
На воздухе в присутствии влаги ржавеет:
4Fе + 3O2 + 6Н2О = 4Fе(ОН)3.
С галогенами оно образует галогениды железа (III)
2Fе + 3Вr2 = 2FеВr3,
а взаимодействуя с соляной и разбавленной серной кислотами соли железа(II), так как катион водорода Н+ является слабым окислителем:
Fе + Н2SО4 = FеSО4 + Н2↑.
Концентрированные (НNО3, Н2SО4) пассивируют железо на холоде, однако растворяют его при нагревании:
2Fе + 6Н2SО4(конц) = Fе2(SО4)3 + 3SО2↑ + 6Н2О,
Fе + 6НNО3(конц) = Fе(NО3)3 + 3NО2↑ + 3Н2О.
Медь – довольно мягкий металл красно-желтого цвета, обладающий наименьшей активностью среди рассмотренных выше переходных металлов, которые вытесняют ее из растворов солей. Медь не реагирует с соляной и разбавленной серной кислотами и растворяется только в кислотах – окислителях:
Сu + 2Н2SО4(конц) = СuSО4 + SО2↑ + 2Н2О,
Сu + 4НNO3(конц) = Сu(NО3)2 + 2NО2↑ + 2Н2О,
3Cu + 8НNО3(разб) = 3Сu(NO3)2 + 2NO↑ + 4Н2О.
Известны соединения меди со степенями окисления +1 и +2, из которых +2 более устойчива.
Ионы Сu2+ в водном растворе существуют в виде комплексов гексааквамеди (II) [Сu(Н2О)6]2+, придающих раствору сине-голубую окраску.
Основная соль меди – медный купорос CuSO4.5H2O голубого цвета, но при прокаливании теряет воду и становится белого цвета, т.е. окраску раствору придает комплексный ион. Более точное строение медного купороса [Cu(H2O)4]SO4.H2O.
Цинк амфотерный металл. Валентные электроны атома цинка 4s23d10. Так как все d-орбитали у цинка заполнены электронами, все его соли бесцветны. Это объясняется теорией кристаллического поля лигандов. В соединениях проявляет только одну степень окисления +2.
Взаимодействует с кислотами:
Zn + 2HCl = ZnCl2 + H2↑
Zn + H2SO4(разб) = ZnSO4 + H2↑
Zn + 2H2SO4(конц) = ZnSO4 + SO2 + 2H2O
4Zn+10HNO3(разб)=4Zn(NO3)2+NH4NO3+3H2O.
Zn + 4HNO3(конц) = Zn(NO3)2 + 2NO2 + 2H2O
Взаимодействует со щелочами: реагирует с растворами щелочей с образованием гидроксокомплексов, при сплавлении образует цинкаты:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + 2KOH = K2ZnO2 + H2↑ | 

 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход Поиск
Поиск Друзья сайта
Друзья сайта Наш опрос
Наш опрос Статистика
Статистика