| Четверг, 25.04.2024, 16:41 | Главная | Регистрация | Вход | |||||
Сайт учителя биологии и географии Лотоцкой Е. Г. |
|
|||||
| « Апрель 2024 » | ||||||
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 29 | 30 | |||||
 Друзья сайта
Друзья сайта
 Наш опрос
Наш опрос
 Статистика
Статистика

| ОГЭ по биологии |
| ОГЭ по географии |
| ОГЭ по химии |
| ЕГЭ по биологии |
| ЕГЭ по географии |
| ЕГЭ по химии |
|
Сокращено количество заданий с 32 до 30 и максимальный первичный балл - с 46 до 45. Отдельные изменения коснулись следующих позиций: в части 1 работы включены новые модели заданий в линиях 1 и 20, в части 2 добавлена новая линия заданий (27), линия 30 (задания 31 и 32 в модели 2019 г.) претерпела значительную переработку.
|
|
Содержание и структура контрольных измерительных материалов по географии определяются необходимостью достижения цели единого государственного экзамена: объективной оценки качества подготовки лиц, освоивших образовательные программы среднего (полного) общего образования, для их дифференциации по уровню подготовки и конкурсного отбора в учреждения среднего и высшего профессионального образования. Содержание КИМ ЕГЭ по географии определяется требованиями к уровню подготовки выпускников, зафиксированными в Федеральном компоненте государственных стандартов основного общего и среднего (полного) общего образования по географии. Отбор содержания, подлежащего проверке в экзаменационной работе ЕГЭ 2018 г., осуществляется в соответствии с разделом «Обязательный минимум содержания основных образовательных программ» Федерального компонента государственных стандартов основного общего и среднего (полного) общего образования по географии. В этом документе выделены основные ... Читать дальше » |
|
Блок 1. География как наука. Современные методы географических исследований, источники географической информации
1.1. Географические модели. Географическая карта, план местности. Их основные параметры и элементы (масштаб, условные знаки, способы картографического изображения, градусная сеть) Глобус (от лат. globus — шар) — это уменьшенная шарообразная модель Земли (другой планеты или небесной сферы) с нанесенным картографическим изображением ее поверхности: очертаний суши и водных пространств, рельефа суши и дна Мирового океана, государственных границ, городов, — сохраняющим геометрическое подобие контуров и соотношение площадей. Чаще всего глобусы имеют масштабы — 1:30 000 000— 1:80 000 000, но в отдельных случаях, например у музейных глобусов, они составляют 1:10 000 000 и крупнее. Географическая карта (от греч. Chartes — лист, свиток) — уменьшенное, математически определенное, обобщенное, о ... Читать дальше » |
|
Блок 2. Природа Земли и человек
2.1. Земля как планета, современный облик планеты Земля. Форма, размеры, движение Земли. Соотношение суши и океана на Земле Планетарные особенности Земли
Основные понятия, процессы, закономерности и их следствия Геоид — истинная форма Земли. Годовое движение Земли вокруг Солнца происходит по орбите. Земная ось постоянно наклонена к плоскости земной орбиты под углом 66,5°. Вследствие этого наклона каждая точка Земли встречает солнечные лучи под углами, которые изменяются в течение года, поэтому происходит смена времен года, а также продолжительность дня и ночи в различных уголках планеты неодинакова. День зимнего солнцестояния (22 декабря), в этот день Солнце в зените над Южным тропиком. В это время к северу от Северного полярного круга наблюдается поля ... Читать дальше » |
|
Блок 2. Природа Земли и человек
2.2. Земная кора и литосфера. Состав и строение. Рельеф земной поверхности. Тектоника литосферных плит Внутреннее строение Земли
Принято делить тело Земли на три основные части – литосферу (земную кору), мантию и ядро.  Ядро, средний радиус которого около 3500 км, как предполагают, состоит из железа с примесью кремния. Наружная часть ядра находится в расплавленном состоянии, внутренняя, по-видимому, твердая. Ядро сменяется мантией , которая простирается почти на 3000 км. Считают, что она твердая, в то же время пластичная и раскаленная. Литосфера – верхняя оболочка «твердой» Земли, включающая земную кор ... Читать дальше » |
|
Блок 2. Природа Земли и человек
2.3. Этапы геологической истории земной коры. Геологическая хронология Геологическая история Земли — последовательность событий в развитии Земли как планеты. Среди этих событий — образование горных пород, возникновение и разрушение форм рельефа, наступания и отступания моря, оледенения, появление и исчезновение видов живых существ. Изучается по слоям горных пород; делится на отрезки согласно геохронологической шкале. Земля образовалась около 4,54 млрд. лет назад путём аккреции из протопланетного диска — дискообразной массы газа и пыли, оставшихся от образования Солнца, которая и дала начало Солнечной системе. Изначально планета была раскалена благодаря остаточному теплу и частым ударам астероидов. Но в конце концов её внешний слой остыл и превратился в земную кору. Немного позднее, в результате столкновения по касательной с небесным телом размера Марса и м ... Читать дальше » |
|
Блок 2. Природа Земли и человек
2.4. Гидросфера. Состав, строение гидросферы. Мировой океан и его части. Поверхностные и подземные воды суши. Ледники и многолетняя мерзлота Гидросфера - водная оболочка Земли. Ее принято делить на Мировой океан, континентальные поверхностные воды и подземные воды. Общий объем воды на планете - около 1 533 000 000 кубических километров (по измерению в 2013 г.). Масса гидросферы - примерно 1,46•1021 кг. Это в 275 раз больше массы атмосферы, но лишь 1/4000 от массы всей планеты. Океаны покрывают около 71% земной поверхности. Средняя их глубина составляет 3800 м, а максимальная (Марианская впадина в Тихом океане) - 11022 м. Океаническую кору слагают осадочный и базальтовый слои. В водах Мирового океана растворены соли (в среднем 3,5%) и ряд газов. В частности, верхний слой океана содержит 140 трлн тонн углекислого газа и 8 трлн тонн кислорода. Поверхностные континент ... Читать дальше » |
|
Блок 2. Природа Земли и человек 2.5. Атмосфера. Состав, строение, циркуляция. Распределение тепла и влаги на Земле. Погода и климат Атмосфера - газовая оболочка, окружающая планету Земля и вращающаяся вместе с ней. Совокупность разделов физики и химии, изучающих атмосферу, принято называть физикой атмосферы. Атмосфера определяет погоду на поверхности Земли, изучением погоды занимается метеорология, а длительными вариациями климата - климатология. Толщина атмосферы 1500 км от поверхности Земли. Суммарная масса воздуха, то есть смеси газов, составляющих атмосферу, - 5,1-5,3*1015т. Молекулярная масса чистого сухого воздуха составляет 29. Давление при 0°С на уровне моря 101325 Па, или 760 мм. рт. ст.; критическая температура - 140,7°С; критическое давление 3,7МПа. Растворимость воздуха в воде при 0°С - 0,036%, при 25°С - 0,22%. |
|
Блок 2. Природа Земли и человек
2.6. Биосфера. Разнообразие растений и животных. Почвенный покров. Почва как особое природное образование, условия формирования почв различного типа Биосфера - совокупность частей атмосферы, гидросферы и литосферы, которая заселена живыми организмами. Этот термин ввел в 1875 австрийский геолог Э. Зюсс. Биосфера не занимает определенного положения, как другие оболочки, а располагается в их пределах. Так, водоплавающие животные и водные растения являются частью гидросферы, птицы и насекомые – частью атмосферы, а растения и животные, обитающие в земле – частью литосферы. Биосфера также охватывает все, что связано с деятельностью живых существ. В состав живых организмов входит около 60 химических элементов, главные из которых - углерод, кислород, водород, азот, сера, фосфор, калий, железо и кальций. Живые организмы могут приспосабливаться к жизни в экстремальных условиях. ... Читать дальше » |
|
Блок 2. Природа Земли и человек
2.7. Географическая оболочка Земли. Широтная зональность и высотная поясность, цикличность и ритмичность процессов. Природные и природно-антропогенные комплексы Географическая оболочка – генетически целостная оболочка Земли, охватывающая нижние слои атмосферы, верхние толщи земной коры, гидросферу и биосферу. Все эти геосферы, проникая друг в друга, находятся в тесном взаимодействии. От других оболочек географическая отличается наличием жизни, различных видов энергий, а также возрастающих и преобразующих антропогенных воздействий. В связи с этим в состав географической оболочки включают социосферу, техносферу, а также ноосферу - результат эволюции географической оболочки. 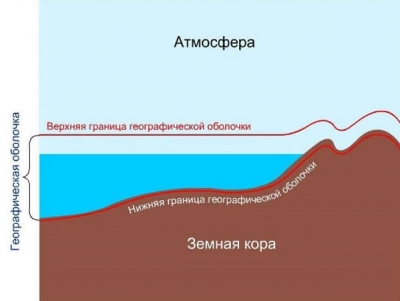 Идея о существовании географической оболочки впервые была высказана российским ученым П ... Читать дальше » |

| Лотоцкая Елена © 2024 | Сайт создан в системе uCoz
Некоторые файлы и информация, находящиеся на данном сайте, были найдены в сети ИНТЕРНЕТ, как свободно распространяемые, присланы пользователями сайта или найдены в альтернативных источниках, также использованы собственные материалы. Автор сайта не претендует на авторство ВСЕХ материалов. Если Вы являетесь правообладателем той или иной продукции или информации, и условия, на которых она представлена на данном ресурсе, не соответствуют действительности, просьба немедленно сообщить с целью устранения правонарушения. |
 Меню сайта
Меню сайта Категории раздела
Категории раздела Вход
Вход Поиск
Поиск
